9-1-2化学方程式的配平
一、氧化数法
(1)根据实验结果写出反应物和生成物的化学式。然后,按物质的实际存在形式,调整分子式前的系数。例如,
KMnO4+2HCl→MnCl2+Cl2
(2)求元素氧化数的变化值。
标出氧化数有变动的元素的氧化数。用生成物的氧化数减去反应物的氧化数,求出氧化剂元素氧化数降低的值和还原剂元素氧化数增加的值。
KMnVIIO4+2HCl-I→MnIICl2+Cl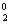
(3)根据氧化剂中元素氧化数降低的数值和还原剂中氧化数升高的数值必须相等的原则,在氧化剂和还原剂的化学式前各乘以相应的系数。
2KMnO4+10HCl→2MnCl2+5Cl2
(4)配平反应前后氧化数未发生变化的原子数。简称原子数配平。一般用观察法。首先,氧化剂和还原剂的氧化数变化必须相等。
2KMnO4+16HCl=2MnCl2+5Cl2+2KCl+8H2O
配平的两个基本要求:首先,氧化剂和还原剂的氧化数变化必须相等。其次,方程式两边的各种元素的原子数必须相等。
二、离子-电子法(半反应法)
例如,KMnO4和FeSO4的反应(酸性介质):
(1)先将反应物的氧化还原产物,以离子形式写出
Fe2+
+ MnO4¯→
Mn2++ Fe3+
(2)写出两个半反应式,一个代表氧化,另一个代表还原,
Fe2+
-e→Fe3+(氧化反应)
MnO4¯+e→
Mn2+(还原反应)
(3)从电极电势表中,查出氧化剂(MnO4-)和还原剂(Fe2+)的相应电对:
Fe2+-e→Fe3+ Ø°=
0.770V
MnO4¯+8H++5e→Mn2++4H2O
Ø°=1.491V
(4)求电子得失数相等:
| ×5)Fe2+-e→Fe3+ |
|
×1)MnO4¯+8H++5e→Mn2++4H2O
|
|
相加得:5Fe2++MnO4¯+8H+→5Fe3++
Mn2++4H2O |
(5)求反应前后原子个数相等,写成分子方程式:
10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+2MnSO4
+K2SO4+8H2O
《上一页∣下一页》
![]()