什么是屏蔽效应和钻穿效应?怎样解释同一主层中能级分裂及不同主层中的能级交错现象?
答 对于单电子原子,各轨道的能量为
E=-13.6z2/n2
单电子体系(如氢原子或类氢离子Li2+等)轨道的能量主要取决于主量子数n。对于同一单电子原子或离子,只要n相同,各轨道的能量就相同:Ens=Enp=End=Enf,这些能量相同的轨道称简并轨道。
在多电子原子或离子中,不但有原子核对电子的吸引,还有电子之间的排斥。在讨论某一电子的能量时,将内层电子对该电子的排斥作用归结为对核电荷的屏蔽和部分抵消,从而使有效核电荷降低,削弱了核电荷对该电子的引力,这种作用称为屏蔽效应。这样一来,多电子体系轨道的能量为
![]()
式中Z*为有效核电荷,σ为屏蔽常数。因此,多电子原子或离子
轨道的能量除与主量子数n有关外,还与屏蔽常数σ值有关。
 而σ值与角量子数l等许多因素有关。在n相同的轨道中,l值越小的电子受内层电子的屏蔽作用越小,故有轨道的能量Ens<Enp<End<Enf,造成“能级分裂”现象。
而σ值与角量子数l等许多因素有关。在n相同的轨道中,l值越小的电子受内层电子的屏蔽作用越小,故有轨道的能量Ens<Enp<End<Enf,造成“能级分裂”现象。
为了解释“能级分裂”现象,必须研究原子轨道的径向分布函数图。
如图1所示,主量子数相同的3s,3p,3d轨道中,角量子数最小的3s轨道不仅径向分布峰的个数最多,而且在靠近核附近有一个小峰(即钻入离核很近的地方),因此3s电子被内层电子屏蔽得最少,平均受核的引力较大,其能量最低(值得指出的是,3s轨道径向分布图中离核较近的峰面积虽小,但这部分电子云出现的区域离核较近,因而有效核电荷大,它对降低轨道能量将起重大贡献);而3p及3d电子钻入内层的程度依次减小,内层电子对其屏蔽作用逐渐增强,故它们的能量相继增大。我们把由于原子轨道的径向分布不同,电子穿过内层钻到近核的能力不同而引起电子的能量不同的现象称为电子的钻穿效应。可见钻穿与屏蔽是互相联系的。
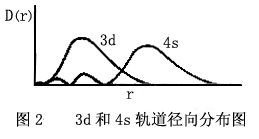 钻穿效应的结果还会引起“能级交错”现象,例如原子序数为19和20等元素的轨道能量E4s<E3d,这是因为4s和3d轨道的径向分布不同(如图2),虽然4s的最大峰比3d最大峰离核较远,但4s的小峰钻到靠核很近的内层,因而大大降低了4s电子的能量,以致于4s比3d电子能量还低。
钻穿效应的结果还会引起“能级交错”现象,例如原子序数为19和20等元素的轨道能量E4s<E3d,这是因为4s和3d轨道的径向分布不同(如图2),虽然4s的最大峰比3d最大峰离核较远,但4s的小峰钻到靠核很近的内层,因而大大降低了4s电子的能量,以致于4s比3d电子能量还低。