|
第一节
苯的结构和休克尔规则
一.苯的分子结构
苯是芳香族化合物的代表,在苯系芳烃中都含有苯环。熟悉苯的分子结构,是研究芳香性的基础。
1865年凯库勒从苯的分子式C6H6出发,根据苯的一元取代物只有一种,提出了苯的环状结构。这就是我们至今仍在使用的苯的凯库勒式。
这个式子虽然可以说明苯分子的组成和原子间的连接次序,但仍存在着问题:凯库勒式既然含有三个双键,为什么苯不起类似烯烃的加成反应;按照凯库勒式,苯的邻二取代物应当有(1)和(2)两种,但实际上只有一种。
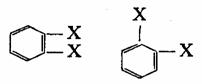
(1)
(2)
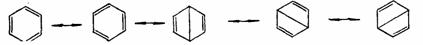
由于上述矛盾问题的存在,引起了化学家对苯结构的极大兴趣,对苯的结构的研究作了大量的工作,提出了不同的结构来表示苯的结构。凯库勒本人曾用两个凯库勒式之间的摆动来表示苯分子的真实结构。

还有化学家分别提出了对位键结构式、双环结构式、棱型结构式、向心结构式等来表示苯的结构。
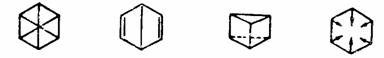
对位键结构式
双环结构式
棱型结构式
向心结构式
但这些结构式都不能反映苯的实际情况,因而陆续被淘汰了,而且其中的双环结构式(Dewar苯)和棱型结构式(棱烷)所代表的化合物已被合成,它们是苯的价键异构体。
上一世纪的三十年代,鲍林在凯库勒苯的结构式基础上,提出了苯的共振结构。共振论能广泛的用于说明和解释苯的性质,但仍未揭示出苯分子价键的本质。
现代物理方法的应用和量子化学的发展为苯的分子结构的确定提供了有力的工具。光谱法、X-射线法、偶极矩的测定等都证明苯分子是平面正六边形构型,键角都是120O,碳碳键的键长相等,都是0.139nm。
苯分子的各个键角都是120O,因此碳原子必须是SP2杂化,形成六个C-Cσ键和六个C-Hσ键,而每个碳原子上剩余的P轨道在一个平面上相互重叠,均匀对称地配布在整个环上,形成一个环状的共轭体系,π电子密度平均化,环上没有单键和双键之分。因而,经典的定域化的价键结构式(环己三烯)不能代表苯的结构。
用分子轨道理论处理苯分子,六个2P原子轨道组成六个分子轨道,
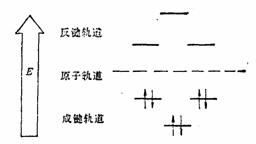
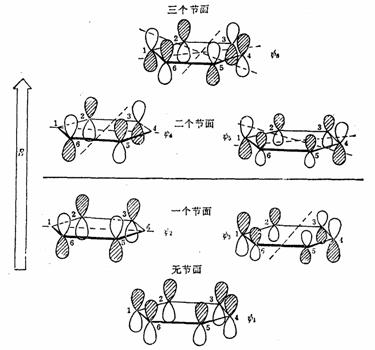
当苯分子处于基态时,三对电子分子分别填充能量低的成键轨道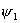 、 、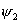 和 和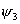 。三个已占有轨道的能量分别是α+2β、α+β和α+β,因为每个轨道有两个电子,总能量 。三个已占有轨道的能量分别是α+2β、α+β和α+β,因为每个轨道有两个电子,总能量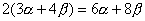 。如果苯有三个一般的双键,则六个 。如果苯有三个一般的双键,则六个 电子的总能量将是 电子的总能量将是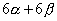 。这样,可以预测真正的苯分子将比假设的不共轭的环己三烯稳定2个 。这样,可以预测真正的苯分子将比假设的不共轭的环己三烯稳定2个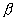 数值,这个数值就是苯的离域能。已知苯的氢化热是-208.2kJ/mol,环己烯的氢化热是-119.6kJ/mol。所以 数值,这个数值就是苯的离域能。已知苯的氢化热是-208.2kJ/mol,环己烯的氢化热是-119.6kJ/mol。所以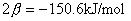 (3×119.6-208.2=150.6), (3×119.6-208.2=150.6),
 。 。
苯分子的环状共轭体系导致苯有较大的稳定性,这就是经典芳香性(aromaticity)
的涵义。
二.休克尔规则
由于苯的环状闭合的共轭体系中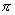 电子的高度离域而导致苯的芳香性,那么由 电子的高度离域而导致苯的芳香性,那么由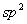 杂化碳原子所组成的任何一个环状化合物似乎应该都具有芳香性。但苯的较低和较高的插烯同系物环丁二烯和环辛四烯都不具有芳香性,虽然它们都是由 杂化碳原子所组成的任何一个环状化合物似乎应该都具有芳香性。但苯的较低和较高的插烯同系物环丁二烯和环辛四烯都不具有芳香性,虽然它们都是由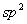 杂化碳原子以单键和双键交替组成的环状结构。 杂化碳原子以单键和双键交替组成的环状结构。

环丁二烯
环辛四烯
在第一章已经讨论过环状共轭多烯烃分子轨道能级排列的规律,即不论是偶数还是奇数P轨道的体系最低的能级轨道只有一个,然后是成对的、依次升高的简并轨道,偶数体系还有一个最高能级的单轨道。不同环多烯烃及其离子的π分子轨道能级和基态的电子构型如下:
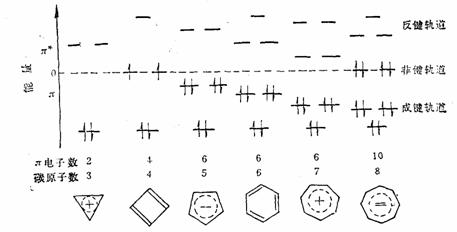
环多烯烃及其离子的π分子轨道能级和基态的电子构型
环丁二烯 体系有一个能量最低的轨道,一对能量相等的简并轨道,和一个能量最高的轨道。 体系有一个能量最低的轨道,一对能量相等的简并轨道,和一个能量最高的轨道。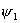 是能量最低轨道, 是能量最低轨道,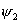 、 、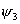 是能量较高且能量相等的两个轨道, 是能量较高且能量相等的两个轨道,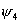 是能量最高的轨道,这里共有三种不同的能级。环丁二烯的四个 是能量最高的轨道,这里共有三种不同的能级。环丁二烯的四个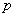 电子充满了 电子充满了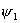 (两个电子),但余下的两个电子只能分别填充能量相等的非键轨道 (两个电子),但余下的两个电子只能分别填充能量相等的非键轨道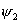 和 和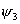 ,而未能充满它们。 ,而未能充满它们。
环丁二烯的四个分子轨道的能量分别为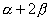 、 、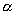 、 、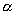 和 和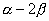 。有二个电子占有 。有二个电子占有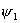 。一个电子占 。一个电子占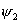 ,一个电子占 ,一个电子占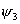 ,所以四个电子总能量 ,所以四个电子总能量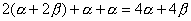 。两个孤立双键的能量也是 。两个孤立双键的能量也是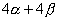 。这样,环丁二烯没有共轭能(即离域能)。因此,环丁二烯没有芳香性。 。这样,环丁二烯没有共轭能(即离域能)。因此,环丁二烯没有芳香性。
因为在平面单环体系中,只有一个低能量轨道,而有一对或几对能量较高的轨道。若要充满一定能级的轨道,在这种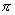 体系中就要有2,2+4,2+4+4,2+4+4+4,…,即2,6,10,14,…个电子。休克尔认为,分子若要显示芳香性,则在 体系中就要有2,2+4,2+4+4,2+4+4+4,…,即2,6,10,14,…个电子。休克尔认为,分子若要显示芳香性,则在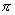 体系中其电子数必需符合 体系中其电子数必需符合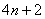 这个数字,这里的 这个数字,这里的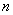 是整数,可以是0,1,2,3…。换言之,凡含有 是整数,可以是0,1,2,3…。换言之,凡含有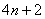 个 个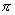 电子的平面单环化合物应具芳香性,这就是休克尔(Hückel)规则。 电子的平面单环化合物应具芳香性,这就是休克尔(Hückel)规则。
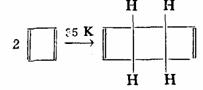
如果体系中含有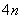 而不是 而不是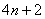 个电子时,就没有芳香性。事实上,环丁二烯极不稳定,比1,3-丁二烯要活泼得多,在35OK就二聚,生成三环〔4.2.0.02,5〕辛二烯-3,7,环丁二烯是反芳香性分子(antiaromaticity)。 个电子时,就没有芳香性。事实上,环丁二烯极不稳定,比1,3-丁二烯要活泼得多,在35OK就二聚,生成三环〔4.2.0.02,5〕辛二烯-3,7,环丁二烯是反芳香性分子(antiaromaticity)。
环辛四烯分子有八个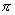 电子,不符合 电子,不符合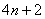 规则,所以它没有芳香性。 规则,所以它没有芳香性。
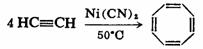
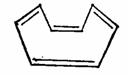
环辛四烯可在氰化镍的催化作用下由乙炔四聚而得。制得的环辛四烯,同苯不一样,显示出高度的不饱和性质,易发生加成反应。光谱研究证明环辛四烯分子不是平面构型,而是盆型结构,碳碳单键键长为0.146nm,碳碳双键键长为0.133nm。环辛四烯属于非芳香性分子。
三.芳香化合物的特点
一般具有芳香性的化合物都具有以下的特点:
1.C/H比例高
苯的分子式是C6H6,萘是C10H8。脂肪族化合物,除了乙炔C2H2外,绝大多数都没有这样高的C/H比。
2.键长趋向平均化
在苯分子中,六个碳-碳键等长,为0.139nm,这是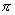 电子离域的必然结果。 电子离域的必然结果。
3.分子的共平面性
组成芳香体系环上的原子必须在一个平面上,或接近在一个平面上。共平面性是芳香性的一个必要条件。
4.离域能,也称共轭能
由于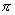 电子的离域,体系能量降低,芳香化合物具有特殊的稳定性。如苯分子的离域能是150.6kJ/mol。 电子的离域,体系能量降低,芳香化合物具有特殊的稳定性。如苯分子的离域能是150.6kJ/mol。
5.化学性质
烯烃和炔烃的典型反应是加成反应,而具有芳香性的化合物却恰恰相反,它们不容易发生加成反应,而倾向于发生亲电取代反应。
6.特征光谱
核磁共振提供了判断芳香性以有力武器。芳环上的氢原子比一般烯键上的氢原子的化学位移明显地移向低磁场,有较大的化学位移值,如苯氢的化学位移值在7左右。大环轮烯,由于分子不可能以全顺式的平面结构存在,因而有环外氢,也有环内氢。一般环内氢移向高磁场。
本节共 1 页 1
上一页
下一节 |