|
问题与习题
12-1
为什么烷烃的典型反应是自由基取代反应?
解
烷烃是饱和烃,C—H键的键矩很小,只有0.4D。对称的烷烃是非极性的,不对称的烷烃偶极矩也很小,如丙烷的偶极矩仅为0.085D,异丁烷的偶极矩为0.132D。所以,烷烃对离子型的试剂的进攻不敏感,只有具有很高能量、很活泼的非极性试剂即自由基,才能从烷烃分子中夺取氢而发生自由基取代反应。
12-2
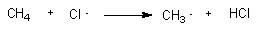
为什么在烷烃的自由基取代反应中,是卤原子夺取烷烃分子的氢,而不是进攻碳?即是反应(1)而不是反应(2)?
CH4 + Cl·
→ CH3·
+ HCl
(1)
CH4 + Cl·
→CH3Cl + H·
(2)
解
从能量说,反应(1)有利。
CH4 + Cl·
→ CH3·
+ HCl
(1)
△=435.1-431=4.1kJ/mol
CH4 + Cl·
→CH3Cl + H·
(2) △=435.1-338.9=96.2kJ/mol
从空间效应来说,Cl·夺取氢比进攻碳有利。而且CH3·比氢原子稳定,易生成。
一些键能数据如下:
CH3—H
435.1kJ/mol
C—Cl
338.9kJ/mol
H—Cl
431kJ/mol
12-3
曾有人将等量甲烷和氯的混合气体通过弧光灯照射,产物经冷凝后分析,发现其中含20%乙烷氯化物。即使用很纯的甲烷作原料,也能得到乙烷的氯化物。扩大实验的规模还可以分离出更高级的烷烃氯化物。试解释产生这一现象的原因。
解
甲烷和氯的混合气体在弧光灯照射下的反应机理如下:
Cl2
→ 2Cl·
(光照或加热)
CH4 + Cl·
→ CH3·
+
HCl
CH3·
+ Cl2 →
CH3Cl + Cl·
产生的一氯甲烷再与氯自由基作用,生成二氯甲烷:
CH3Cl +
Cl·
→
·CH2Cl
+ HCl
·CH2Cl
+ Cl2 →
CH2Cl2 +
Cl·
该反应生成的自由基CH3·和CH2Cl·可能发生如下反应而生成氯乙烷或更高级的氯化物:
CH3·
+ CH3·→
CH3CH3
CH3CH3
+ Cl·
→ CH3CH2·
+ HCl
CH3CH2·
+ Cl2 →CH3CH2Cl
+ Cl·
CH2Cl·
+ CH2Cl·
→ CH2ClCH2Cl
CH3·
+ CH2Cl·→
CH3CH2Cl
12-4
甲烷和氯的反应通常在光照或必须在加热至250℃时才开始发生反应,但在无光照条件下,如加入少量(0.02%)的四甲基铅[Pb(CH3)4],则加热至140℃,氯化反应即可顺利进行。试用反应机理进行解释。
解
四甲基铅[Pb(CH3)4]在加热的情况下,易发生Pb-C键的均裂,而引发如下反应:
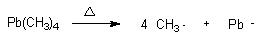

循环进行,反应即可顺利进行。
12-5
正丁烷分别进行氯化和溴化,其产物的组成很不一样,试解释之。
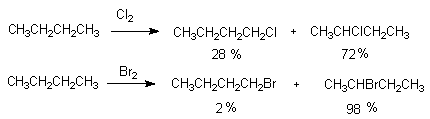
解
这是由于氯化和溴化的选择性和活性不一样的结果。室温下氯化时,氯对叔、仲、伯氢原子的相对活性为5:4:1,而溴化时为1600:82:1,即溴化的选择性非常高,故正丁烷溴化时有98%的2-溴丁烷。
12-6
本世纪三十年代美国化学家M.S.Kharach等对烯丙基溴与溴化氢的反应进行了深入的研究。他们发现在此反应混合物中加入痕量的有机过氧化物,能使加成反应在几小时内完成,并得到反马加成产物。反应式如下:
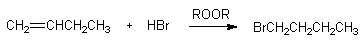
请用不同类型自由基的稳定性对该反应的结果给予一个合理的解释。
解
有机过氧化物中-O-O-键的离解能为:146-209
kJ·mol-1,加热时容易裂解而产生自由基:
RO-OR
→
2RO·
RO·自由基从溴化氢分子中夺取氢原子,生成溴原子:
RO·
+ HBr
→ ROH + Br·
溴原子加在烯烃的碳-碳双键上,生成烷基自由基:
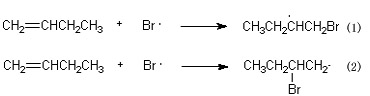
由于自由基的稳定性为:R3C·>
R2CH·>RCH2·,所以溴原子主要按(1)途径进行反应,加在含氢较多的碳原子上,生成稳定的自由基。从而得到反马加成产物。
12-7
由甲基环己烷和环己烷合成一种卤代物,是用Cl2还是Br2?为什么?
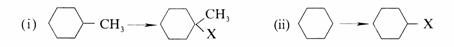
解
(ⅰ)溴化,因溴化反应的选择性高。
(ⅱ)溴化和氯化均可。
12-8
解释下列反应得此两个产物得原因,并估计哪一个产物较多?
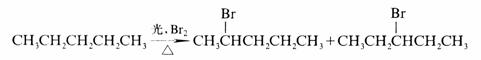
解
溴化反应的选择性高,主要是2OH的反应。戊烷分子中有两种2OH,C-2和C-4的2OH是等同的,共有4个,C-3的2OH是两个。主要产物是2-溴戊烷。
共 2 页 1
2 |