|
第一节 亲电加成反应
碳碳双键包含一个强的σ键和一个弱π键。富电子的π电子受原子核的束缚力较小,又容易极化,容易受到亲电试剂的进攻,碳碳双键的加成,主要是亲电加成反应。但是,当碳碳双键连接有吸电子基团时,π键电子云密度降低,也能发生亲核加成反应。关于烯烃的亲核加成反应,将在下一节讨论。炔烃的亲电加成反应与烯烃相似,但叁键较难被亲电试剂进攻,其亲电加成反应活性比烯烃低,相反,炔烃比烯烃容易受亲核试剂进攻,发生亲核加成反应。
一.鎓离子历程
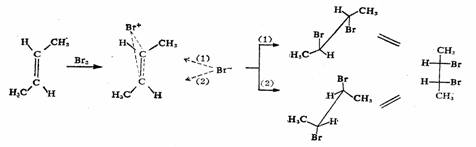
烯烃双键的亲电加成反应历程,其中以溴化反应研究得较为清楚。很多实验事实已证明,在极性环境下(容器或少量极性物质)烯烃与溴的加成反应是按两步亲电加成反应机理进行的。第一步是极化了的烯烃双键与极化的溴分子作用生成π络合物,进而生成三元环状正离子中间体—溴鎓离子。这是决定整个反应速度的步骤。反应的第二步是溴的负离子(Br-)从溴鎓离子的背面进攻双键两个碳原子之一,生成1,2-二溴化物。因为反应是二级的,故称为AdE2历程。
反-2-丁烯
内消旋-2,3-二溴丁烷
简单和非共轭的烯烃认为生成溴鎓离子,因为相应的碳正离子比较不稳定,溴鎓离子所有的原子具有八电子层,而碳正离子只有六个价电子。近代理论计算结果表明溴鎓离子比相应的碳正离子中间体在能量上低40kJ/mol。
其它一些亲电试剂,如氯、碘、次卤酸(HOCl、HOBr)以及在水或醇存在下汞盐如Hg(OCOCH3)2的加成也大抵按相似历程进行。
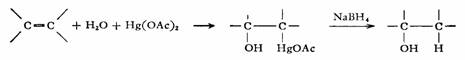
烯烃和醋酸汞在水或醇存在时,生成羟基汞化物,后者用NaBH4还原成醇,反应称为烯烃羟汞化—脱汞反应。该反应可在温和的条件下进行,产率很高,比烯烃直接水合要方便得多。

立体化学证明反应中间形成了一个环状离子中间体。反-2-丁烯与氯或溴加成生成内消旋-2,3-二溴丁烷,顺-2-丁烯则生成外消旋-2,3-二溴丁烷。环己烯与溴或次卤酸加成生成反式产物。经鎓离子历程的亲电加成是反式加成。
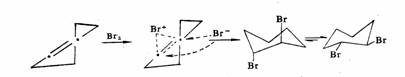
环己烯
反-1,2-二溴环己烷
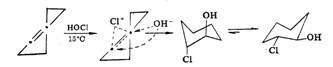
环己烯 反-2-氯环己醇
二.碳正离子历程
烯烃与HX的加成反应历程有两种。一种是经过碳正离子的AdE2历程。如异丁烯与HCl的稀水溶液作用,动力学是二级反应,质子加到双键上生成碳正离子是定速步骤,随后生成的碳正离子与亲核试剂Cl-很快反应生成产物。
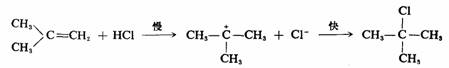
实验证明,烯烃与亲电试剂的加成,若生成的碳正离子的正电荷能够在碳骨架中发生离域,碳正离子较稳定,则有利于碳正离子的AdE2历程,Cl2和Br2与双键上连有苯环的烯烃的加成反应,一般也是按碳正离子的AdE2历程进行的。
按碳正离子的AdE2历程进行的加成反应,一般不具有立体选择性。
某些烯烃的加成反应,除得正常的加成产物外,还得到重排产物,这是碳正离子的AdE2历程的有利证据之一。
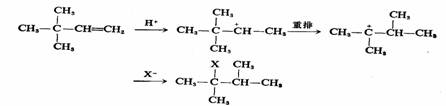
某些烯烃与HX的加成反应另一种历程是经过三分子的过渡态而进行的,烯烃先以较快的速度形成H-X烯烃络合物,然后再与另一分子H-X作用,完成加成反应,得反式加成产物。总的反应是三级动力学, ,称为三分子亲电加成反应,用AdE3表示。一般来说,烯烃与卤化氢的加成,若生成比较不稳定的碳正离子,则倾向于AdE3历程。因为这时需要另一分子HX的X-与之结合,使之生成稳定的产物。 ,称为三分子亲电加成反应,用AdE3表示。一般来说,烯烃与卤化氢的加成,若生成比较不稳定的碳正离子,则倾向于AdE3历程。因为这时需要另一分子HX的X-与之结合,使之生成稳定的产物。

不对称烯烃与不对称的亲电试剂的加成按马尔柯夫尼柯夫(Mарковников)规则进行。无论是碳正离子的AdE2历程还是AdE3历程,都可以把碳正离子作为反应的活性中间体,碳正离子的稳定性决定了加成反应的主要方向。
本节共 2 页 1
2 |