|
问题和习题
1-1写出分子式为C4H10O所有异构体,说明你写出这些异构体的依据是什么?它们之间都是什么异构体?
解
分子式为C4H10O的化合物是饱和化合物,因含有氧原子,分子式为C4H10O的化合物为醇类和醚类。共有八个异构体,其中醇类有五个,醚类有三个。
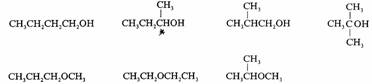
推导出这些异构体的依据:(1)碳4价、氧2价、氢1价;(2)碳原子可组成碳链;(3)碳原子的四面体构型。根据这些原则,按照书写路易斯结构式的要求书写结构式,符合路易斯结构式要求的,都是合理的异构体。
醇类和醚类是官能团异构。1-丁醇和2-丁醇之间是官能团的位置异构。2-丁醇和2-甲基丙醇之间是碳干异构。官能团异构、位置异构和碳干异构属于构造异构。其它异构体之间的关系不再列举。2-丁醇含有一个手性碳原子,有一对对映体,是构型异构体。
1-2
写出下列分子或离子的一个或几个可能的路易斯结构式,如有孤电子对,请用黑点标明。
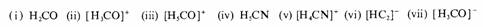
解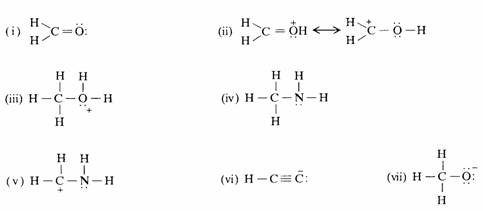
1-3
CO2和H2O都是三原子分子,CO2的偶极矩为0,是非极性分子,而H2O偶极矩为1.84D,是极性分子,为什么?
解
根据书写路易斯结构式的要求,分别写出CO2和H2O的路易斯结构式。在CO2的路易斯结构式,中心碳原子以双键分别与两个氧原子成键,中心碳原子一定是SP杂化的,
CO2一定是线型分子。C=O键是极性键,两个C=O极性键的极性大小相等方向相反,互相抵消,CO2的偶极矩为0,是非极性分子。
H2O的路易斯结构式除两个C-H键外,还含有两对未共用电子对,中心氧原子一定是SP3杂化的,
H2O一定是角型分子。
1-4
CH3—CH3、CH3—CH=CH2和CH2=CH—CH=CH2分子的C—Cσ键的键长分别是0.1530nm、0.1510nm和0.1466nm,你如何解释键长的这种差别。
解
用杂化轨道理论、共振论和共轭效应都可以解释。
1-5
画出环戊二烯分子轨道示意图,用(+)、(-)号标明P电子原子轨道的位相。
解
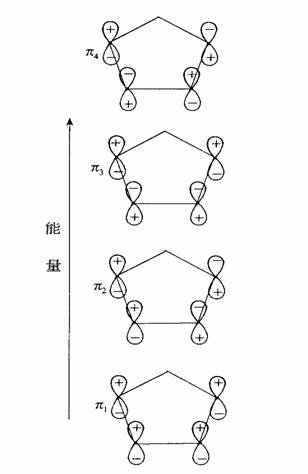
共 3 页 1 2 3 |