10-3-1.类似水的两性溶剂
醇类作为溶剂时和水相似,但它们的相对电容率εr(介电常数)比水小。甲醇在298K时的εr=32.6;乙醇EtOH的εr=24.3;而对水来说,εr=78.5。
像下面一类的平衡:
NH4++EtOH![]() NH3+EtOH2+
NH3+EtOH2+
其特点是离子分布在方程式的两边。溶剂的电容率对平衡常数影响较小。因为与H2O相比,EtOH是相当强的碱,
![]() /
/![]() 的数值大约比
的数值大约比![]() /
/![]() 数值大六倍多。
数值大六倍多。
而像下面的一类平衡
RNH2+EtOH![]() RNH3++EtO-
RNH3++EtO-
方程式中的离子在同一边,因醇类的电容率较低,使平衡常数远比在水溶液中相应反应的平衡常数小。
在电容率为![]() 的介质中,相距为r分别带正电+e和负电-e的一对离子的静电自由能可用下式求出:
的介质中,相距为r分别带正电+e和负电-e的一对离子的静电自由能可用下式求出:
| G= |
|
因为![]() ,在水中和在乙醇中静电自由能的差可由玻恩(Born)方程式得到:
,在水中和在乙醇中静电自由能的差可由玻恩(Born)方程式得到:
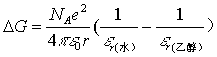
当电荷相距200pm时:
|
|
|
=–1.97
|
|
=–19.7kJ·mol-1 |
对于电离时产生两个单电荷离子的酸而言,它在水中和在乙醇中的平衡常数的比可从下式得到:
|
|
|
|
| =7.95 |
在式中,Ka(在水中)/Kb(在乙醇中)~3000。其数量级与所观察到的数值相同,这表明它们性质上的差异,主要是由于离子间吸引力的不同。