10-4-2
因而对于酸的电离作用:
![]() H=D-Ax+
H=D-Ax+![]() +I
+I![]() +
+![]()
所有的二元化合物的酸的最后二项(I![]() 及
及![]() )都是常数,从一种酸到另一种酸的电离能变化必须取决于开头的三项。电离常数自然是取决于
)都是常数,从一种酸到另一种酸的电离能变化必须取决于开头的三项。电离常数自然是取决于![]() G,而不是
G,而不是![]() H,但是据大部分已充分研究的结果表明在一系列的二元化合物的酸中,熵的差值还不致影响酸的强度变化趋势。
H,但是据大部分已充分研究的结果表明在一系列的二元化合物的酸中,熵的差值还不致影响酸的强度变化趋势。
在NH3、H2O和HF这一系列中,增加电子亲合能(A)是提高酸强度最恰当的原因;但是在HF到HI这一类酸中,决定的因素或许是离解能(D)的降低。
(ii)通式为HnXOm的含氧酸,按酸根分子中氧和氢原子的比例可很清楚地将它们分成四类:
(a)m=n,如HOCl、HOBr、H3BO3和H6TeO6,一级电离的pK值在7和11之间。
(b)m=n+1,如HClO2、HNO2、H2SO3和H3PO4,pK值接近于2。
(c)m=n+2,如HNO3,HClO3和H2SO4,pK值在-1到-3之间。
(d)m=n+3,如HClO4,pK值接近于-8。
显然,过去曾被怀疑的碲酸符合于表中的H6TeO6而不是H2TeO4·2H2O。而亚磷酸和次磷酸pK分别为2和1,按照它们已知的碱度其化学式应为HPO(OH)2和H2PO(OH)。酸强度的增加似乎与其阴离子的稳定性有关。中心原子的电荷数越大、电负性越大,则使阴离子带电的那些电子所占据的分子轨道的能量就越低。
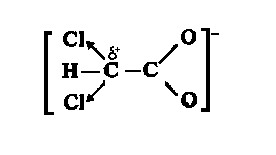
(iii)脂肪族酸的pK大约为5。用电负性高的元素(F、C1)取代烷基中的氢能增加酸的强度,当取代一个以上的氢原子或取代的氢原子位于最接近羧基的碳原子时尤为显著。例如,在二氯醋酸离子中,通过氯增加了烷基上碳的电负性,吸引了由氧原子传给另一个碳原子的部分负电荷,从而降低了整个离子的能量,增加了该离子的稳定性。