
2-2-2-3 含有d轨道的杂化作用
由于d轨道的参予,主要杂化类型的数目从3(直线型、三角型、四面体)增加到40种以上,幸而其中只有少数几种才能形成强键体系。
双锥体杂化(sp3d)。一个典型的双锥体分子是五氯化磷PCl5(图2-25),气态时它是单分子的。在中心平面上可以是sp2杂化,形成三个互成120°角的键。第三个P轨道同合适的d轨道混合,因为两者都对中心轴对称,故形成一个向上和一个向下的杂化轨道,(如图2-26)所示。
在这样的情况下,可料想两个氯原子的成键与另三个稍有不同;事实上,平面上方和下方的键稍长一些。相应的第一短周期的元素氮,并不形成这样的化合物,因为它们没有2d原子轨道,而3d原子轨道能量又太高,不能明显的混合。因此NF3(sp3杂化)是最高的氟化物。
八面体杂化(sp3d2)。SF6(图2-27)是这种类型的分子,它有四个互成直角的键位于硫的平面上,另外两个键在该平面的上方和下方,所形成的两个垂直的键基本上与双锥体分子中的一样,但是平面上的键最好用有第二个d轨道参加的杂化来描述。平面杂化轨道的一种形成方式如图2-28所示。这样生成的四个杂化轨道与另外两个不是完全等价的,但如允许稍加混合,就能得到六个完全等价的杂化轨道;它们正是八面体的各个顶点。(如图2-28)
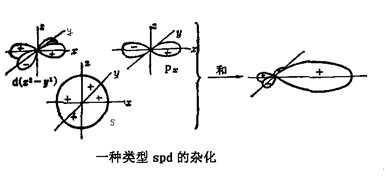
图2-28
平面正方形杂化(dsp2),某些离子有四个指向正方形各个顶点的平面轨道,在平面上方或下方没有原子(图2-29)。Ni(CN)![]() 和PtCl
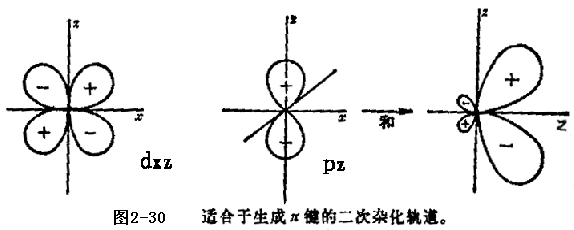
和PtCl![]() 都是“正方形’离子的例子。图2-28中表示的杂化作用对它们也是适用的。然而在这类平面形离子中,有可能在原有的杂化键体系上附加上二次成键体系,后者是由价电子层中剩余的轨道构成的。在平面正方形例子中,二次成键体系可以由平面外的轨道(一个p和三个d)形成,如图2-30所示。图2-30这样的轨道在分子平面上有一个节面,因而具有π键特性。它们能够与所指向原子的p轨道重叠,构成一个π叠加在原来的
都是“正方形’离子的例子。图2-28中表示的杂化作用对它们也是适用的。然而在这类平面形离子中,有可能在原有的杂化键体系上附加上二次成键体系,后者是由价电子层中剩余的轨道构成的。在平面正方形例子中,二次成键体系可以由平面外的轨道(一个p和三个d)形成,如图2-30所示。图2-30这样的轨道在分子平面上有一个节面,因而具有π键特性。它们能够与所指向原子的p轨道重叠,构成一个π叠加在原来的![]() 键上。如果有足够的电子可利用时,这类双健在平面络合物中确实是很重要的。
键上。如果有足够的电子可利用时,这类双健在平面络合物中确实是很重要的。
必须注意在前面两个例子中,混合的轨道是属于相同量子层(3s,3p,3d)的。然而,通常所用的d轨道却属于较低量子层(例如4s、4p、3d),对于这一点,可把d轨道写在前面来表示。因此,上述最后的例子(Ni,Pt)是dsp2杂化。