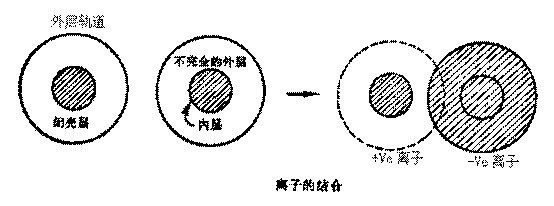
分子之间的作用力又称范德华力,按作用力产生的原因和特性可分为三部分:取向力、诱导力和色散力。
1.取向力
具有永久偶极矩的分子,如HCl,称为极性分子。极性分子与极性分子之间,偶极定向排列而产生的静电作用力称为取向力(图7-3)。显然,分子电偶极矩愈大,这种静电作用能越大。
2.诱导力
当极性分子与非极性分子靠近时,极性分子的偶极使非极性分子变形,产生的偶极叫做诱导偶极。诱导偶极与极性分子的固有偶极相吸引产生的作用力,称为诱导力(图7-4)。

把完全分离的单元如冰或萘中单独的分子结合在一起的力较共价键为弱,其中最强的力通常称为“静电”键,它表示这种力是由分离体系原有静电荷分布的相互作用所引起的。存在于水合物和氨合物中的离子—偶极键就是这样的例子。它们往往比一般的共价键弱,加热时较容易断开。这种结合力是由正离子和孤对电子云之间的吸引产生的。孤对电子轨道并不需要同其它原子上的轨道明显地混合,故重叠很少。吸引作用主要是由在分离体系中非常不对称的电荷分布引起的,但轨道的某些混合(共价),对它也有些作用。

3.色散力
由于每个分子中的电子和原子核皆处在不断的运动之中,因此,经常会发生电子云和原子核之间的瞬时相对位移,结果产生了瞬时偶极。两个瞬时偶极必然是处于异极相邻的状态,而相互吸引,称为色散力。
具有高度对称性的18族气体(图1-15)原子之间的静电相互作用是极小的,然而在它们的气体和液体中确实存在着微弱的远程力。要说明这些范德华力,需要引用电荷密度会受另一电荷密度所微扰而作更精确的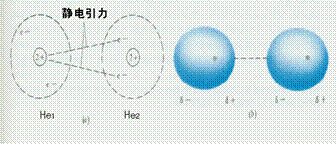 处理。每个电子体系都能使另一体系诱导出一个弱的偶极,所给出的极化力取决于有关体系的极化率,并随距离的六次方而减小。与此同时,两个体系电子运动的相互关系又产生进—步的吸引力。伦敦(London)首先认为,这种力象是迅速变化着的电偶极之间的力,他称之为色散力。现在知道,色散力在相当大的距离上起着作用,并且当(a)一个体系处于激发态时,(b)体系是等同时(“共振”相互作用的情况),色散力为最强。这样,原子或小分子之间的范德华力可以得到很好的解释,但是对大分子之间的这种力,至今还只有部分的了解。这种力总是作为“高次”效应出现的,在决定分子晶体和许多其它非金属固体的内聚性方面也起着作用。这些力通常被一起存在的典型的化学键所完全掩盖。色散力普遍存在于各种分子之间,并且没有方向性。分子的分子量愈大,越容易变形,色散力就越大。
处理。每个电子体系都能使另一体系诱导出一个弱的偶极,所给出的极化力取决于有关体系的极化率,并随距离的六次方而减小。与此同时,两个体系电子运动的相互关系又产生进—步的吸引力。伦敦(London)首先认为,这种力象是迅速变化着的电偶极之间的力,他称之为色散力。现在知道,色散力在相当大的距离上起着作用,并且当(a)一个体系处于激发态时,(b)体系是等同时(“共振”相互作用的情况),色散力为最强。这样,原子或小分子之间的范德华力可以得到很好的解释,但是对大分子之间的这种力,至今还只有部分的了解。这种力总是作为“高次”效应出现的,在决定分子晶体和许多其它非金属固体的内聚性方面也起着作用。这些力通常被一起存在的典型的化学键所完全掩盖。色散力普遍存在于各种分子之间,并且没有方向性。分子的分子量愈大,越容易变形,色散力就越大。
分子间作用力有以下特点:
(1)一般它只有几十个kJ·mol-1,比化学键能小1-2个数量级。
(2)分子间作用力的范围约几百pm(10-12m),一般不具有方向性和饱和性。对于大多数分子,色散力是主要的。只有极性很大的分子,取向力才占较大比重。诱导力通常都很小。