 |
 |
物质主要分为三种聚集状态:气态、液态和固态。在现代无机化学中,对固态物质的研究尤为重要。这是因为现代科学技术赖以发展的各种光学、电学和磁学材料,主要的存在形式是固体物质。现代人们认识物质的结构以及结构和性能间的关系,主要是通过深入研究固体物质而获得。固体中原子间排列位置固定,在一种结构的基础上,可以设法通过掺入其他原子、除去一些原子或者使一些原子发生位移和变形等多种方式予以改造,而获得性质完全不同的材料。固体中原子间可以通过多种型式的化学键结合在一起,物质的多样性源于化学键的多样性。
固体中共同存在的一些有关化学键的基本问题:离子键、金属键和能带理论,以及氢键和分子间作用力。其中,离子键的讨论见第3章。本章则简要地介绍氢键和分子间作用力,并讨论金属键和能带理论。
7-1氢键和范德华力
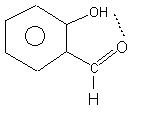
已经同一个原子键合的氢原子,再能和电负性大的元素如氟、氧、氮原子的孤对电子间形成氢键(图7-1)。其中H…F是最强的氢键,能量约为σ键的十分之—,键长约为σ键的二倍。氢键是引起冰(图7-2)具有能向空间伸展的四面体结构的主要原因,其中每一个氢(具有一个净的正电荷)通过孤对电子与相邻的氧原子相连。液态水中继续存留了这种氢键结构,它使水的沸点比16族其它非金属相应的氢化物为高。同理,氨和氟化氢的沸点也比15和17族中其它相应的氢化物为高。类似的O…H键也存在于许多聚合物中,例如在非极性溶剂中,它使羧酸键成二聚物。在邻羟基芳香醛和邻硝基苯酚中,分子内的O…H键阻止了特征的O—H振动, 这种振动通常在红外光谱上可显示出来。
 |
 |
氢键也使这些化合物在水中的溶解度降低,而具有正常O—H振动频率的间位和对位异构体,在水中的溶解度要大得多。