(i)体心立方,如Na, K, Mo, Fe。
金属与非金属的区别,一般在于(a)它们有很好的导热性和导电性;(b)它们有高的机械强度和延展性,这些性质是金属中键合的非定域性的直接结果。像丁二烯中的π电子一样,这些电子是流动的。金属的结构及金属键可用离域的价电子来表征,这些价电子使金属具有高电导性。离子键和共价键不同于金属键,它们的价电子定域于某些特定原子上,不能自由地在固体中迁移。
金属键:由于自由电子不停地运动,把金属原子或离子联系在一起。金属键不具有方向性和饱和性。
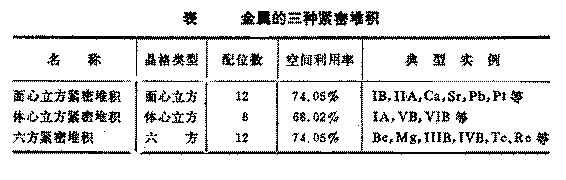
典型金属有1族(1A),2族(ⅡA),11族(ⅠB)族元素和包括镧系,锕系在内的过渡元素。除了锰和铀以外,它们的结构都属于下面三种简单结构之一:

(i)体心立方,如Na,
K, Mo, Fe。
(ii)面心立方,如Cu,Ag,Au,Fe.
(iii)六方密堆积,如Be,Mg,Zr。
在结构(i)中,最相邻近的原子数目即晶体的配位数是8。显然,用正常的电对共价键来说明它们的结合,电子数是不够的。例如,钠只有一个价电子,无论如何它们不可能与相邻原子都构成正常共价键。它只能以“分数”键形式共用电子,正像丁二烯(4个电子组成3个分数π键)或苯(6个电子组成6个分数π键)中那样;不过,在金属中电子分布要更为广泛,同时晶体中的键序必然更要小些。