9-2-2判断反应方向
氧化还原反应发生的方向:
强氧化型1+强还原型2=弱还原型1+弱氧化型2
在标准状态下,标准电极电势较大的电对的氧化型能氧化标准电极电势数值较小的电对的还原型。
利用标准电极电势定量地判断氧化还原反应方向的具体步骤:
(1)求出反应物和生成物中元素的氧化数,根据氧化数的变化确定氧化剂和还原剂;
(2)分别查出氧化剂电对的标准电极电势和还原剂电对的标准电极电势;
(3)以反应物中还原型作还原剂,它的电对为负极,以反应物中氧化型作氧化剂,它的电对为正极,求出电池标准状态的电动势:
E°E°E°
若E°>0,则反应自发正向(向右)进行,以符号→表示;若E°<0,则反应逆向(向左)进行,以符号←表示。
例1:判断反应Zn+Cu2+=Cu+Zn2+是否向右进行?
查出标准电势,求出电池电动势:
E°=Ø°+-Ø°-
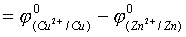
=0.337-(-0.7628)=1.10
V
E°=Ø°+-Ø°->0,
∴反应自发向右进行。
例2:以铁和铜为例说明金属活动顺序与标准电极电势是什么关系?
解:金属活动顺序表中铁在氢的前面。这是指纯金属铁可以置换1molL-1
H+。而氢又在铜的前面。这是指氢气在101.3kPa
(298K),氢离子浓度为1molL-1时,氢分子可以从1molL-1的铜离子溶液中置换出金属铜。
反应式如下:→
Fe+2H+=Fe2++H2↑
(-)氧化反应:Fe2++2e=Fe(Ø°=0.440V)
(+)还原反应:2H++2e=H2(Ø°=0.000V)
电池电动势:E°=Ø°+-Ø°-
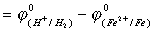
=0.00-(-0.440)
=0.440V
E°=Ø°+-Ø°->0,
\反应自发向右进行。
Cu2+ + H2 = Cu+ 2H+
(-)氧化反应:
H2=2H++2e(Ø°=0.000V)
(+)还原反应:
Cu2++2e=Cu+(Ø°=0.337V)
E°=Ø°+-Ø°-
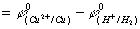
=0.337-0.000=0.337
E°>0,
∴反应自发向右进行。
《上一页∣下一页》