+0.59V
-0.05V
9-4-2
上面的图形是指pH=0时锰化合物的反应。在碱溶液(pH=14)中,锰化合物的反应就不同,其拉蒂默图和埃布斯沃思曲线也就不同。
图9-8
pH=14时,锰的拉蒂默图
| 氧化态 | +7 | +6 | +4 | +3 | +2 | 0 | |||||
| 物质 |
MnO |
+0.58V | MnO |
+0.6V | MnO2 | -0.2V | Mn(OH)3 | +0.2V | Mn(OH)2 | -1.55V | Mn |
| Eo |
+0.59V |
-0.05V |
|||||||||
下图为“半反应”的自由能曲线图(pH=14)。在碱性条件下,Mn(OH)3几乎完全歧化为Mn(OH)2和MnO2:
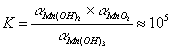
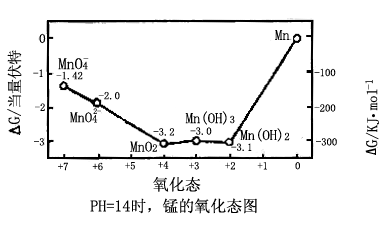
Mn(OH)2和MnO2都是热力学稳定的物质(在+2和+4态均为最低点)。锰(VI)酸根离子在碱性溶液中的歧化倾向较在酸性溶液中为小,通过+7,+6和+4态的连接线几乎是直线,它意味着
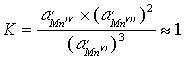
因此,锰的这三种氧化态的物质能以较高的浓度同时存在于碱溶液中;在氧化态图中,当三种或更多种氧化态可以通过直线连接在一起时,则它们能以这样的平衡状态存在。
因为![]() 在强碱性溶液中并不歧化,所以在强的KOH水溶液中氧化MnO2可制得K2MnO4的碱性溶液。但是即使加入很弱的酸就会使六价锰酸盐歧化为高锰酸盐和二氧化锰:
在强碱性溶液中并不歧化,所以在强的KOH水溶液中氧化MnO2可制得K2MnO4的碱性溶液。但是即使加入很弱的酸就会使六价锰酸盐歧化为高锰酸盐和二氧化锰:
3![]() +4H+→2
+4H+→2![]() +MnO2+2H2O
+MnO2+2H2O
用氧化态图可以说明元素在不同氧化态时相对的热力学稳定性。