9-4-1
埃布斯沃思(E.A.V.Ebsworth)曾提出用图解法表示元素的不同氧化态之间的关系。他不用氧化还原电位而用各种“半反应”的自由能对氧化态作图。半反应式为:
M→Mz++ze
严格说,完全的反应式为:
M+zH+→Mz++![]() zH2
zH2
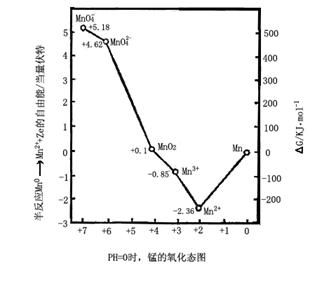
图中的纵坐标代表以金属为基准,在pH=0时各种氧化态的吉布斯自由能。右图为锰的氧化态图,可与上面的拉蒂默图相比较。从Mn氧化为Mn2+的反应Mn+2H+→Mn2++H2
即半反应:Mn→Mn2++2e
的吉布斯自由能的改变为-2e![]() l.18eV=-2.36eV。因而Mn2+的
l.18eV=-2.36eV。因而Mn2+的![]() G值较Mn低2.36eV(Mn0的
G值较Mn低2.36eV(Mn0的![]() G为0)。在这点和0.0点之间引一直线,其斜率+2.36/2即为该电对的标准氧化还原电位E0,Mn2+/Mn。
G为0)。在这点和0.0点之间引一直线,其斜率+2.36/2即为该电对的标准氧化还原电位E0,Mn2+/Mn。
用类似方法引用锰的拉蒂默图中的数据可标绘出其他各点。例如MnIII的点是在MnII点上面1.5leV等等。从右到左所标绘的点可得出一个氧化态顺序,它和I.U.P.A.C.所采用的方式—致。
M(氧化型)+电子→M(还原型)
这种图解法对一种元素的氧化—还原溶液化学提供了清楚的概念。例如,上述情况说明,最低点为Mn2+,它表示相对于Mn0和从MnIII到MnVII的所有氧化态而言,Mn2+是热力学稳定状态。MnVI的位置高于从MnVII到MnIV的连接线,表明MnVI将很大程度地歧化为MnVII和MnIV态。但对于下列平衡:
3MnIV ![]() MnVI+2MnIII
MnVI+2MnIII
因为MnIV的点远低于从MnVI到MnIII的直线,K值实际上是很小的。然而,对于下列平衡:
2MnIII ![]() MnIV+MnII
MnIV+MnII
因为MnIII位于“凸”点,K值就较大。