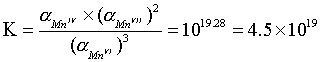9-4具有几种氧化态的元素
大多数的非金属和过渡金属的化学表明这些元素能以数种氧化态存在。若借助于直观的方法,例如氧化还原电位图归纳各种氧化态之间的关系,那是很有用的。对于锰的一般氧化态按拉蒂默(W.T.Latimer)的一种方法,图解如图9-7,此处是采用I.U.P.A.C.(国际纯粹和应用化学联合会)的通用符号。
图9-7
pH=0时,锰的拉蒂默图
| 氧化态 |
+7 |
|
+6 |
|
+4 |
|
+3 |
|
+2 |
|
0 |
| 物质 |
MnO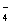 |
+0.56V |
MnO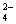 |
+2.26V |
MnO2 |
+0.95V |
Mn3+ |
+1.51V |
Mn2+ |
-1.18V |
Mn |
|
Eo |
+1.69V |
+1.23 |
|
|
Eo |
+1.51V |
|
拉蒂默图中用线段连接组成半电池的两种物质,线段上标出了测得的标准氧化还原电位,这样就归纳了各种氧化态之间电位的数量关系。例如+0.56V相应于从MnO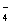 到MnO
到MnO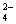 转移1个电子的标准氧化还原电位(a),从MnO
转移1个电子的标准氧化还原电位(a),从MnO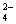 到MnO
到MnO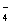 转移2个电子的Eo为+2.26V(b),因而由MnO
转移2个电子的Eo为+2.26V(b),因而由MnO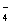 到MnO2转移3个电子所得到的E,MnO
到MnO2转移3个电子所得到的E,MnO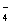 /MnO2为+1.69V(c),注意转移3个电子的氧化还原电位(c)=(2b+a)/3。这一结果是可以预计的,因为在pH=0时,不管反应的历程如何,半反应
/MnO2为+1.69V(c),注意转移3个电子的氧化还原电位(c)=(2b+a)/3。这一结果是可以预计的,因为在pH=0时,不管反应的历程如何,半反应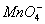 →MnO2的吉布斯(Gibbs)自由能变化(ΔrG=-nFE)都相等。
→MnO2的吉布斯(Gibbs)自由能变化(ΔrG=-nFE)都相等。
 G=-nFE
G=-nFE
=-3e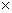 l.69V
l.69V
=-(e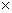 0.56V)-(2e
0.56V)-(2e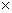 2.26V)
2.26V)
因为所有Eo值是与Eo(H+/H2)=0相比较所得,所以这里的半反应实际上是指在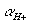 =1.00溶液中用标准压力下的氢所产生的还原反应,但是下面为了方便起见我们将用“半反应”表示。
=1.00溶液中用标准压力下的氢所产生的还原反应,但是下面为了方便起见我们将用“半反应”表示。
这些数字也提供了锰酸盐可能歧化为高锰酸盐和二氧化锰混合物的依据:
3MnVI→2MnVII+MnIV
将下列“半反应”
3MnVI→2MnVII+2e
 Go=+2
Go=+2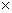 0.56eV
0.56eV
和
MnVI+2e→MnIV
 Go=-l
Go=-l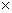 2.26eV
2.26eV
相加,得到
3MnVI→2MnVII+MnIV
 Go=-1.14eV
Go=-1.14eV
因为 Go=-RTlnK,又1eV=9.65
Go=-RTlnK,又1eV=9.65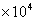 J×mol-1,所以
J×mol-1,所以
lgK=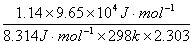 =19.28
=19.28
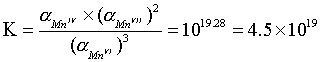
可见在298K时,平衡常数K=4.5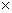 1019的数值很大。这表明在pH=0的水溶液中锰(VI)酸根离子几乎完全歧化为
1019的数值很大。这表明在pH=0的水溶液中锰(VI)酸根离子几乎完全歧化为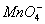 离子和MnO2。
离子和MnO2。
练习
《上一页∣下一页》