一、离子浓度改变时E的变化
氧化型物质浓度减小时,电极电势更负,正值减小。难溶化合物或配合物的生成使氧化型的离子浓度减小时,电势值变小,还原型的还原性加大,稳定性减小;氧化型的氧化性减小,稳定性加大。
二、离子浓度改变对氧化还原反应方向的影响
例1判断2Fe3++2I-=2Fe2++I2的反应方向。
解:在标准状态:
(-)氧化反应:I2+2e=2I-(Ø°=0.535V)
(+)还原反应:Fe3++e=Fe2+(Ø°=0.770V)
E°=j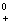 -j
-j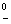
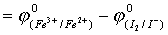
=0.770-0.535=0.235>0
E°>0,
∴反应自发向右进行。
反应方向为:2Fe3++2I-=2Fe2++I2
在非标准状态:[Fe3+]=
0.001molL-1,[I-]=
0.001molL-1,[Fe2+]=1molL-1时反应方向如何?
氧化剂: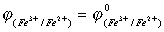 +{0.0592
lg[Fe3+]/[ Fe2+]}/n
+{0.0592
lg[Fe3+]/[ Fe2+]}/n
=0.770+0.0592
lg(0.001/1)
=0.770+0.0592×(-3)
=0.770-0.178
=0.592V
还原剂: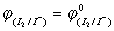 +{0.0592lg[I2]/[I-]2}/2
+{0.0592lg[I2]/[I-]2}/2
=0.535+{0.0592lg1/(0.001)2}/2
=0.535+0.0592×3=0.535+0.178
=0.713V
E=0.592-0.713=-0.121<0
∴反应逆向进行:2Fe2++I2=2Fe3++2I-
对于电池电动势比较小的反应,离子浓度的改变有可能引起反应方向的改变;而电池电动势较大的反应,即两电极电势差较大时,离子浓度虽然大大改变,反应仍可正向进行。
当电池电动势较大时(可以用0.5V作一粗略的参考数值),离子浓度改变一般不致于引起反应逆转,这时常可以直接用标准电势判断反应的方向,离子浓度改变对电势的影响可以忽略。
《上一页∣下一页》