|
第五节
手性合成
一.分子的准手性
分子中的“对称结构单位”,经过取代或加成等化学反应后失去其对称性而生成不对称结构单位的性质,称为分子的
“准手性”(也称“准不对称性”、“前手性”、“潜手性”)。发生反应的结构单位称为准手性结构单位。常见的准手性结构单位可分为两种类型:
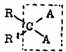 A为原子或原子团
A为原子或原子团
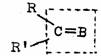 B为O、NH、CH2、CRR/ B为O、NH、CH2、CRR/
(1)
(2)
准手性结构单位中的碳原子称为准手性碳(或准手性中心),反应过程中准手性中心能变成手性中心,上述两种情况除B为CRR/有可能同时产生两个手性中心外,其余皆产生一个手性中心。
具有准手性中心的分子本身可能是对称的(非手性的)或不对称的(手性的),它们与一些试剂发生反应后所生成产物的构型关系是应该注意的。具有准手中心的非手性分子,反应产物为外消旋体,可拆分为对映体,例如:
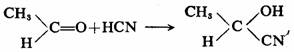
(±)-α-羟基丙腈
具有准手性中心的手性分子,产物为非对映体。例如:
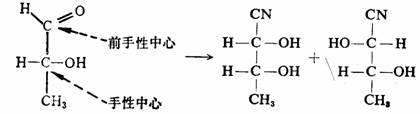
非对映体
这里,反应物中手性碳原子C2*不被反应所涉及,它的原来构型完整的被保留到两种立体异构产物中;而反应物中准手性碳原子在变成手性碳原子C1*时,两种产物中的C1*的构型呈对映关系。
二.手性合成的定义和评价指标
前面已经讲过,用非旋光性物质在一般条件下合成旋光性物质时,通常得到的多是外消旋体,但无论在研究或实际应用中,常是需要分别得到左旋体和右旋体,这不仅需要经过比较复杂的拆分手续;而且有用的又往往是一对对映体中的一个,这是很不经济的。若能采用一定的方法,只合成某一有旋光性的异构体或使其得率较高,是非常可取的。这就是手性合成(或不对称合成)所要解决的问题。所谓手性合成是指手性分子或非手性分子中的准手性单位被转化成手性单位,并生成不等量的立体异构体的过程。按这个定义,除去少数特殊例子之外,通过手性合成得到的产物,其整体都应该是手性的和非外消旋的。凡是含有准手性中心的分子,在手性试剂、催化剂或反应环境,以及不对称物理因素(如偏振光)的作用下发生反应时,产生一对对映体中的一种占优势的结果;此外,同时含有手性中心和准手性中心的分子,在与非手性试剂反应时,原分子中手性中心对反应起诱导作用,生成另一个新的手性中心,其结果得到不等量的非对映体;当一个外消旋体与一手性剂剂作用时,其中一个对映体的反应速度大于另一个,也属于手性合成。
当手性合成的产物为一对对映体时,评价手性合成优劣的指标,可用对映体过量百分数(%e,.e.)或旋光纯度百分率(%O.P.)来表示:
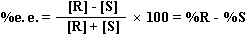
其中[R]为主要对映体产物的百分含量(假设它的构型为R),[S]为次要对映体的百分含量。
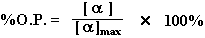
其中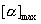 表示对映体之一的纯品的比旋光度,
[α]表示产物在相同条件下观测到的比旋光度。一般情况下,常假定比旋光度与产物的组成之间成线性正比关系,所以“%O.P.”等于“%e.e.”是正确的,只有少数例外。 表示对映体之一的纯品的比旋光度,
[α]表示产物在相同条件下观测到的比旋光度。一般情况下,常假定比旋光度与产物的组成之间成线性正比关系,所以“%O.P.”等于“%e.e.”是正确的,只有少数例外。
在产物为非对映体时,也可以类似地定义非对映体过量百分数(%d.e.)
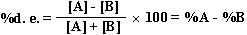
其[A]为主要非映体的百分含量,[B]为次要非对映体产物的百分含量。但是,非对映体之间并不存在旋光方向相反而旋光度数绝对值相等的关系。因此,%d.e.不能与旋光性的测定简单地关联起来,而需用其它办法测定%d.e.。就手性合成而言,自然是%e.e.或%
d.e.越高越好,最理想的情况是接近100%,近年来已有这样实例的报导。
三.手性合成的方法
手性合成是近代有机合成中一个很活跃的领域,研究工作一直很有进展。进行手性合成的方法大体可分为四种;偏振光照射法,生物化学方法,手性溶剂和手性催化剂法,反应物的手性中心诱导法。四种方法都是在手性因素的影响下利用立体选择反应而实现手性合成的,只是手性因素有所不同罢了。前三种手性因素,物理的、生物的、溶剂和催化剂是反应的手性环境或手性条件,而第四种方法是反应物或试剂(即一种反应物)结构上的手性因素。现分别简介如下:
(一)偏振光照射法
用右旋偏振光照射反应物,则产物的右旋体过量。如:
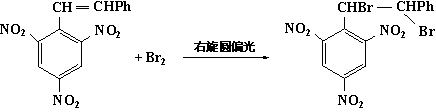
右旋体过量
由于在反应的全部过程中没有别的旋光性物质参加,所以叫绝对手性合成。关于绝对手性合成的研究,其意义目前并不在于有机化学的手性合成,因为所得产物的%e·e都很低(小于1%),远不如相对的手性合成,对于绝对手性合成的研究,至少现在还是纯理论性的,可以用来探索自然界中最初可能出现的一些手性合成是怎样发生的。
(二)生物化学方法
就是利用微生物发酵的方法,或自生物体内分离出催化某一反应的酶,使之实现手性合成。这是由于作为生物催化剂的酶本身是有旋光性的物质,分子中含有多个手性中心,所以它们的催化作用常具有很强的专一性,结果使反应的选择性和反应产生的旋光纯度常接近100%。例如,苯甲醛与氢氰酸加成,在一般条件下得到外消旋体,在D-羟腈酶(苦杏仁酶)的作用下,则可得含97%的R(+)-苦杏仁腈和3%的S-(-)-的对映体。R(+)的%e·e·高达94%:
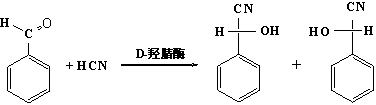
苯甲醛 R(+)-苦杏仁腈 S-(-)-苦杏仁腈
由于具有较高稳定性的酶的选择和分离是比较困难的,因此这种方法的应用是十分有限的。
(三)手性催化剂和手性溶剂存在下的手性合成
当反应物和试剂均为非手性化合物时,而在手性催化剂的作用下或手性溶剂的影响下皆可实现手性合成。手性催化剂依是否具有可溶性则有多相和均相之分。多相手性催化剂主要是用Pa或Raney镍沉附(附着)在具有手性中心的载体上而制成,以手性载体(光学活性物质)作为手性合成的手性源。最为有效的均相手性催化剂就是用手性膦作配体的过渡金属(钌、铑等)有机络合物,以成功地应用于手性合成中,有的手性膦作配体铑的催化剂,在合成氨基酸的反应中,立体选择性已高达99%。

(四)反应物或试剂的手性中心诱导下的手性合成
利用反应物或试剂分子中已存在的手性因素的诱导作用,对分子中的准手性单位进行立体选择性反应,从而完成手性合成,这是手性合成最重要和常用的方法,下面仅以三个实例分别代表三种较典型的情况,说明立体选择性反应是如何实现的。
共 2 页 1
2 |