|
1.手性化合物为起始反应物的手性合成:
这类手性合成的起始反应物主要是α-碳原子为手性中心的链状手性醛和酮,而常用的非手性试剂中有格氏试剂、醇铝及金属氢化物等。例如,2-苯基丙醛和碘甲基镁的反应生成赤藓型和苏阿型的3-苯基-2-丁醇,前者的%e·e·约为50%:
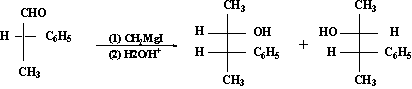
(S)-2-苯基丙醛 (2S,3S)-赤藓型
(2R,3S)苏阿型-
在含有一个手性中心的反应物中,经过反应增加另一个手性中心,生成的非对映体混合产物中有一种构型占优势,这是一种立体选择性反应。这里涉及CH3MgI对>C=0的加成反应方向问题。哪种方向对反应有利,可用对反应物的构象分析及其原有手性中心的诱导作用(1,2手性诱导)来加以说明。这里所说的诱导作用,是指反应物的原有手性碳原子对反应中生成的另一个手性碳原子的构型的影响。这种影响是通过原手性碳上积体不同的三个基团在不同的方位上,对进攻试剂有不同的空阻而产生的。在上述加成反应中,反应物在反应时的优势构象是手性碳上最大的基团与羰基处于反位的平分式构象,而格氏试剂中的甲基负离子,在一般情况下,选择位阻最小的方向上进攻羰基碳原子,结果导致这种从有利途径(H的-侧)进攻>C=O中碳原子所得产物为优势产物:
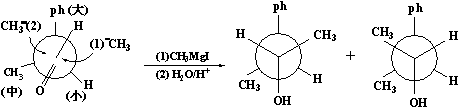
也可用透视式来表示反应的立体选择性:
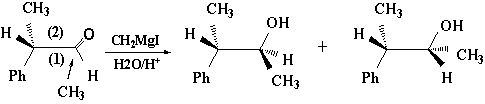
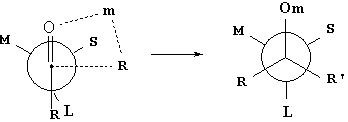
如果用一般反应式来表示这种1、2诱导作用的立体选择性反应;这就是手性合成中的克莱姆(Cram)规则:
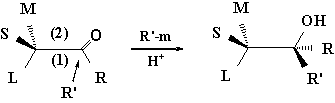
其中L、M、S分别代表具有微弱极性因而不能与有机金属原子配位的大
、中、小三种基团,当L、M和S三者之一为羟基或氨基时,分子内成氢键的构象为反应时的优势构象,当三者之一为电负性很大的卤原子时,则与羰基氧原子间存大较大排斥作用,情况比较复杂。
根据不饱和体系构象分析的一般原则,优势构象应为重叠式,为什么这里羰基化合物在反应时的优势构象却为平分式呢?可以认为格氏试剂、醇铝及金属氢化物等这些试剂(R,-m)在与羰基碳原子发生加成反应之前,它们的金属部分(m)都先与羰基氧原子配位,而大大地膨胀了羰基氧原子一端,于是与手性碳原子上最大的基团L处于反式向位,>C=O处于平分M、S的位置,而R和L处于重叠的向位,则成为最为有利的优势构象,其反应的中间过程可表示如下:
2.在非手性的起始反应物中引入手性因素的手性合成
当起始反应物和试剂均为非手性化合物时,可以在起始反应物中引入一个(或几个)手性中心,导致对起始反应物的准手性单位的反应施加影响,使之成为立体选择性反应,从而完成手性合成,例如,用非手性的苯甲酰甲酸乙酯和CH3MgI经加成水解反应后得到的是外消旋的2-苯基-2-羟基丙酸。
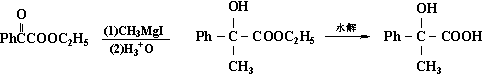
(±)-2-苯基-2-羟基丙酸
但要用苯甲酰甲酸与手性醇的酯经上述反应则可得到右旋体占优热的混合物,%e·e·为24%。
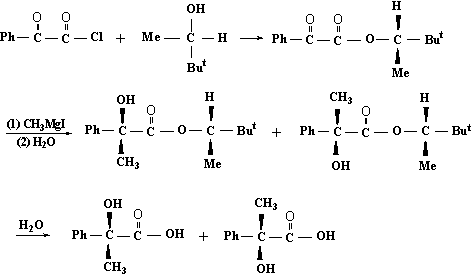
S(+)-
-2-苯基-2-羟基丙酸 R(-)
--2-苯基-2-羟基丙酸
S(+)体之所以比R(-)体多24%,其原因是酯分子中的手性中心对>C=0的加成反应起了诱导作用(1,4手性诱导)。据认为苯甲酰甲酸S(+)-3,3-二甲基-2-丁醇酯分子的优势构象如(A),其中苯甲酰甲酰氧基是一平面构型,介于手性碳上所连的RS和RM之间。
R/MgX从纸平面前方即RS所在的方向进攻羰基碳较为有利(空阻小),所以生成S(+)型的2-苯基-2-羟基丙酸占优势。
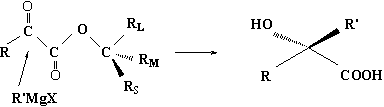
(A)
如果把上述手性合成的实例归纳为一般情况,就是由a-酮酸为原料,通过a-酮酸酯与R,MgX反应,在α-C上增加一个R,基,合成具有旋光性的α-羟基酸,如果用一般的醇成酯,最后产物为外消旋体,而用旋光性醇成酯,则在酮酸的分子中引入一个手性中心,则此手性中心对准手性基团>C=O的加成方向起诱导作用,致使反应具有立体选择性,在有利构象下,试剂从手性碳RS的一面进攻有利,完成立体选择性反应后,把α-C变成了手性中心,这时再把引上来起诱导作用的手性中心去掉,完成手性合成。上述合成方向的选择性,R,MgX是优先从Rs面进攻羰基,这就是手性合成中的prelog规则。Prelog规则同cram规则一样也是经验规律。
3.手性试剂与非手性反应物的手性合成
这种手性合成包括手性的负氢转移试剂对酮羰基的还原反应和手性试剂对烯烃双键的加成反应两种类型。米尔文-彭道夫-沃莱(Meerwein-ponndorf-Verley)还原反应是负氢转移的典型实例。如6-甲基-2-庚酮用S(+)-2-丁醇作还原剂进行反应时,可得优势产物S-(+)-6-甲基-2-庚醇:
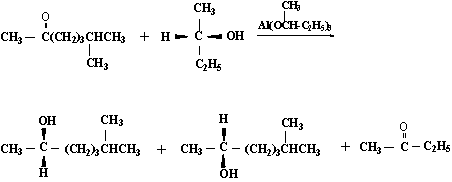
S-(+)-6-甲基-2-庚醇
R-(-)-6-甲基-2-庚醇
为什么S-(+)-型异构体为优势产物?这与反应过渡态的构象有关。现在一般认为米尔文-彭道夫-沃莱还原反应的过渡态呈一六元环状结构。有下面的(Ⅰ)和(Ⅱ)两种可能,在(Ⅰ)式中两个较大的基团(-C2H5)和-C6H13)在环的两侧,相互影响较小易于形成;在(Ⅱ)式中两个较大的基团在环的同侧,相互影响大而不易形成。所以由(Ⅰ)式生成的产物占优势。
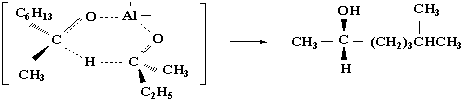
(Ⅰ)
优势产物
S-(+)-6-甲基-2-庚醇
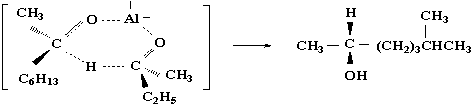
R-(-)-6-甲基-2-庚醇
可见优势产物的构型是受手性醇的构型所制约,即负氢对>C=O的加成还原的立体选择性是由还原剂手性醇的手性中心的诱导作用(通过环状过渡态)而产生的。此外,手性的格氏试剂和手性的金属氢化物也可作为负氢转移试剂,通过环状过渡态对>C=O进行还原反应。
手性硼烷为试剂对C=C双键进行硼氢化-氧化反应也可实现手性合成,产物的立体选择性是通过四元环状过渡态而产生的。

%e·e·
99.1%
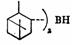
二(3-蒎基)硼烷,一种常用的手性硼试剂。
共 2 页
1 2
下一节 |