|
第一节 诱导效应
一.共价键的极性与诱导效应
共价键虽然由电子对共用所构成,但电子并不一定是平均共用的,也就是说,在成键原子之间电子云的分布并不一定是完全对称的,除非是相同双原子分子如氢分子H-H,或是连有相同基团的如H3C-CH3。由不相同原子或基团所形成的共价键,由于成键原子对电子的作用力不同,电子云并不是平均分布的,而是偏移向共价键的一端,共价键的一端带有部分正电荷,另一端带有部分负电荷,共价键具有极性(polarity),称为极性共价键,如氯化氢分子。
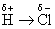
一般以箭头表示电子移动的方向, 和 和 表示部分正,负电荷,不代表整个电荷,如为整个电荷的移动将构成离子键。 表示部分正,负电荷,不代表整个电荷,如为整个电荷的移动将构成离子键。
共价键的极性主要决定于成键原子的相对电负性(electronegatiuity)。电负性指不同元素原子吸引电子的能力,其值为相对量。根据鲍林的定义计算出主要的元素原子的电负性值如下:
H2.1
C2.5
F4.0
Cl3.0
Br2.8
I2.5
O3.5
S2.5
N3.0
P2.1
Si1.8
Li1.0
Na0.9
K0.8
共价键极性的量度是偶极矩(dipole
moment),偶极矩等于电荷与正,负电荷中心距离的乘积:
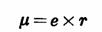
其单位为D(Debye)。偶极矩是向量,一般以箭头的方向表示偶极的负端,例如,溴苯的偶极矩:
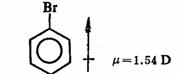
分子的偶极矩为键偶极矩的向量和,例如邻二溴苯的偶极矩为2.63D,间二溴苯为1.54D,而对二溴苯则向量和为零。
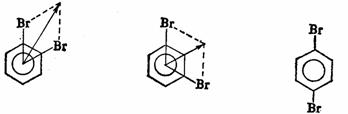
μ=2.63D μ=1.54D
μ=0
实际上,直接测量分子中个别键的偶极矩是不可能的,我们只能测定整个分子的偶极矩,不过由于一定的共价键键的偶极矩在不同的分子中大致相近,因此,可借以计算某些共价键、官能团和分子的偶极矩。例如:

μ=0.43D
μ=3.93D
因此,
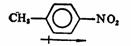
μ=4.36D(实测值μ=4.39D)
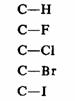
一般常见的官能团的键偶极矩如下。
 
共价键的极性不仅决定于成键原子的电负性,而且受着相邻键和不直接相连原子和基团的明显影响。例如C-C键在乙烷中是非极性的,但在氯乙烷中,由于受了相邻C-Cl键的影响,C-C键与在乙烷中不同,也发生了极化。这是因为电负性较大的氯原子引起的C-Cl键极化,而影响到C-C键的结果。
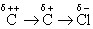
这种由于成键原子电负性不同所引起的电子云沿键链(包括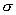 键和 键和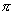 键)按一定方向移动的效应,或者说,键的极性通过键链依次诱导传递的效应,称为诱导效应(inductive
effects)。它是体现着分子中原子之间相互影响的电子效应,以I表示。 键)按一定方向移动的效应,或者说,键的极性通过键链依次诱导传递的效应,称为诱导效应(inductive
effects)。它是体现着分子中原子之间相互影响的电子效应,以I表示。
在有机化学中,诱导效应的方向是以C-H键作为标准,比氢电负性大的原子或基团具有较大的吸电性,叫吸电基或叫亲电基,由其所引起的诱导效应称为吸电诱导效应或叫亲电诱导效应,以-I表示。比氢电负性小的原子或基团则具有供电性,叫供电基或斥电基,由其所引起的诱导效应称为供电诱导效应或叫斥电诱导效应,以+I代表。
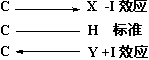
二.
诱导效应的传递
诱导效应沿键链的传递是以静电诱导的方式进行的,只涉及电子云分布状况的改变,只涉及键的极性的改变,一般不引起整个电荷的转移,价态的变化。如氯乙酸和丙酸的诱导效应可表示如下:
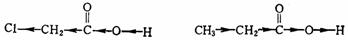
由于氯原子吸电诱导效应影响的依次诱导传递,促进了质子的离解,增强了酸性,而甲基则由于供电诱导效应的依次诱导传递的影响,阻碍了质子的离解,减弱了酸性。
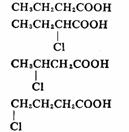
诱导效应的传递受屏蔽效应的影响是明显的,因此诱导效应的强弱与距离有关,随着距离的增加,由近而远依次减弱,愈远效应愈弱,而且变化非常迅速,一般经过三个原子以后诱导效应已经很弱,相隔五个原子以上则基本观察不到诱导效应的影响。在下列取代酸中可以看出随着氯原子与羧基距离的增加,酸性明显下降。
pKa

诱导效应不仅可以沿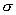 键链传递,同样也可以通过 键链传递,同样也可以通过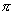 键传递,而且由于 键传递,而且由于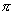 键电子云流动性较大,因此不饱和键能更有效地传递这种原子之间的相互影响。 键电子云流动性较大,因此不饱和键能更有效地传递这种原子之间的相互影响。
三.诱导效应的相对强度
诱导效应的强度主要决定于官能团中心原子电负性的大小,比氢原子相对电负性愈大,则-I效应愈强,比氢原子相对电负性愈小,则+I效应愈强。一般讲,诱导效应的强度次序可从官能团中心原子在元素周期表中的位置来判断。因为元素的电负性在同周期中随族数的增大而递增,在同族中随周期数增大而递减,所以愈是周期表右上角的元素电负性愈大,-I效应也愈强。例如
-F>-OH>-NH2>-CH3
-F>-Cl>-Br>-I
一般说,中心原子带有正电荷的比不带正电荷的同类官能团的吸电诱导效应要强,而中心原子带有负电荷的比同类不带负电荷的官能团供电的诱导效应要强。例如:
-I效应

+I效应

如果中心原子相同而不饱和程度不同时,通常随着不饱和程度的增大,吸电的诱导效应增强。
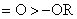
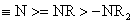
本节共 2 页 1
2 |