|
第一节
几种反应历程
有机化合物的氧化反应与还原反应历程的讨论受到很大的局限,原因之一是在氧化还原作用中键的变化是多种多样的,二是当所用氧化剂和还原剂不同时,其反应历程可能有很大区别,通常只广泛地研究许多可能试剂中的一种或数种所涉及的反应历程,第三是关于氧化反应和还原反应历程的研究工作比较少,但在近年来这方面的研究工作也在迅速增加。
虽然氧化反应和还原反应历程不能像我们所讨论过的其它反应历程那样能归纳成一个总的反应历程,但仍然可能列出一些范畴稍广的反应历程。
1.电子直接转移历程
在有机化学反应中我们可能遇到一些氧化反应,它们直接失去电子;或还原反应它们直接得到电子。伯奇(Birch)还原反应,就是这种还原反应的一个例子。
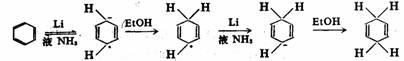
可溶性金属的还原反应和电解氧化-还原反应都属于这一类。
例如科尔贝(Kolbe)电解反应,羧酸根离子在阳极失去一个电子生成自由基,酰氧自由基脱羧,生成的烷基自由基偶联生成烃。
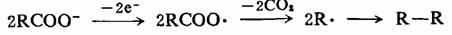
2.氢负离子转移历程
在某些有机反应中发生氢负离子转移,例如,康尼查罗(Cannizzaro)反应,反应过程中一个分子将氢负离子转移结另一个分子,它自己被氧化而另一个分子被还原。
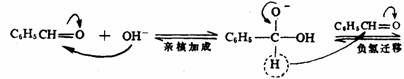

硼氢化钠、氢化锂铝、硼烷和异丙醇铝等都是负氢转移试剂,但它们还原反应的历程是不相同的。
3.形成酯中间体历程
许多氧化作用在反应过程中生成酯类中间体(一般为无机酸酯),此酯中间体再进一步反应,生成氧化产物。铬酸氧化仲醇成酮、烯烃用高锰酸钾或四氧化锷氧化成α-二醇、α-二醇被高碘酸或四乙基铅氧化为二羰基化合物等都认为是生成酯类中间体的历程。
4.加成—消除反应历程
烯丙位的C—H键被氧化,生成醇或酮。常用的选择性氧化剂是二氧化硒(SeO2),反应是加成—消除历程。
下面分氧化反应和还原反应两节,对一些重要的氧化—还原反应再作一些深入的讨论。
共 1 页 1
下一节 |