|
第二节 还原反应
还原反应是有机合成中最普遍的反应类型之一,在官能团的转换方面有着极其广泛的用途。根据还原剂种类和还原过程的不同,还原反应可分为催化氢化法和化学还原剂法两类。而化学还原剂又可分为金属氢化物还原剂、可溶金属还原剂、醇铝还
原剂以及其它类型还原剂等。不同的还原剂具有不同的还原活性和选择性。
一.催化氢化法
在过渡金属(Pt、Pd、Rh、Ru、Ni)或其化合物的催化下,不饱和化合物加氢还原成饱和化合物的反应称为催化氢化。催化氢化的应用范围很广,从双键到叁键,从芳环到杂环,都可被还原成饱和结构,许多官能团也可被还原。催化氢化法具有操作简便、反应快速、产物纯、产率高等特点,而且在一定条件下,可以优先选择对催化氢化活性高的基团。不同基团被催化氢化的大致难易次序为:
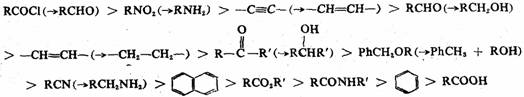
括号内为被催化氢化的产物。
1.烯和炔的催化氢化
叁键比双键容易被氢化,可使炔烃部分氢化为烯烃。常用的催化剂是林德拉(Lindlar)催化剂(简称为Lindlar
Pd)。由于在林德拉催化剂中加入了抑制剂醋酸铅和喹啉使钯部分毒化,降低了催化活性,故当叁键与双键共存时,使用林德拉催化剂,可将叁键还原成双键,得二烯类产物。叁键
比双键容易氢化的原因,可能是叁键较双键易被催化剂表面吸附之故。

碳-碳双键催化氢化的活性比羰基高。因此,当双键与羰基共存时,有可能选择性地还原双键而保留羰基:
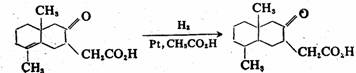
81%
多烯类化合物进行催化氢化时,也是位阻小的双键优先被还原。例如:
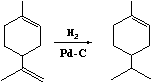
98%
催化氢化的机理目前还不完全清楚,比较一致的看法是,氢气和不饱和的键首先被催化剂表面吸附,被吸附的键发生松驰,随后发生氢原子从催化剂表面向不饱和键的转移,被还原分子脱吸附而完成反应。这一过程可示意为:
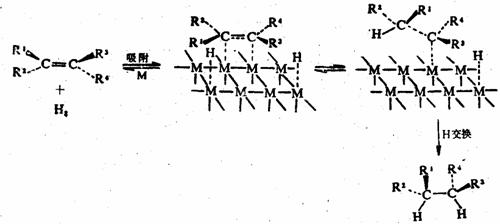
上述过程说明:催化剂不仅起反应场所的作用,而且还起活化反应物的“加工厂”或“中继站”作用。这一过程还告诉我们,催化加氢是发生在重键空间阻碍较小的一面的顺式加成反应。利用氢化的立体专一性,可将不饱和化合物还原成一定构型的产物。例如,二苯基乙炔部分催化氢化为顺二苯基乙烯:

顺二苯基乙烯
87%
2.芳烃的催化氢化
芳烃可用催化氢化还原,由于破坏芳环的共轭体系需要较高的能量,故反应条件比较强烈。例如,在PtO2催化下,需在1~1.5Mpa的压力下,芳烃才能还原成环已烷衍生物。酚进行催化氢化,继而氧化生成的环己醇是制备取代环己酮的好方法。
3.氢解反应
卤代烷或其它碳-杂化合物在催化氢化条件下,可发生碳-杂原子被氢原子取代,该反应称为氢解反应。C-X键的氢解提供了将卤素从分子中移去的有效方法,苄卤、烯丙卤等分子中比较活泼的卤原子比烷基卤化物更容易进行脱卤氢解。酰氯氢解还原成醛,而不继续还原为醇,这一反应称为罗森孟德(Rosenmund)还原,常用控制剂为喹啉-硫。分子中的硝基、醛基、酯基均无影响。
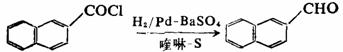
共 4 页 1
2
3
4 |