|
二.可溶金属还原
可溶金属是一类有效的还原体系,它可以还原多种不饱和体系。虽然此法逐渐被催化氢化和氢化物还原法所代替,但可溶金属还原法具有良好的化学选择性和立体选择性,目前仍被广泛应用于有机合成中。常用的金属有钠、钾、钙、锌、镁、铁和锡等。其中碱金属可用其液氨溶液或低沸点的胺溶液,也可悬浮于乙醚、甲苯等惰性溶剂中,通常加醇或水作质子源。有些反应也可直接加入金属钠或者将锌、锡或铁加到被还原物质的乙醇、醋酸或稀的矿酸溶液中。电子由金属的表面或从溶解的金属转移给欲还原的分子。当电子转移给重键时,则发生加成,生成负离子自由基。在许多情况下立即质子化,生成的自由基可从金属获得另一个电子,生成负离子。它既可进一步质子化,也可以负离子进一步反应。若没有质子源,也可发生负离子的二聚或多聚。氨提供质子的能力比较弱。
1.炔烃和共轭二烯烃的可溶性金属的还原
二取代炔烃容易被可溶金属还原,产物为反式烯烃。炔烃的催化氢化或硼氢化反应则生成顺式烯烃。这些不同的方法在由炔烃制备烯烃的合成中可互为补充。
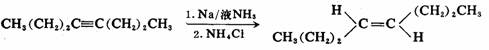
反应历程可能是两个电子对碳碳叁键的多步加成,生成双负离子。两个负电荷的SP2轨道位于反式,彼此远离,比较稳定。
炔烃Pd-c或二异丁基氢化铝作催化剂进行氢化,可得顺式烯烃;而用Na-NH3作还原剂进行还原时,则得反式烯烃。这种立体化学差异性提供了合成不同立体异构体产物的根据。
末端炔烃于可溶性金属形成金属炔化物。由于炔碳上带有负电荷,阻止了它的还原。
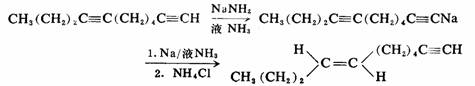
75%
除立体化学的差异外,两种还原方法的位置选择性也不相同。例如多炔烃用Pd-C进行催化加氢时,位阻小的末端叁键优先反应,而用Na-NH3法还原,则位阻大的链中叁键优先被还原。
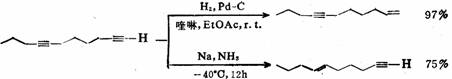
共轭二烯烃可用溶解金属法还原,反应按1,4-加成的方式进行。共轭双键从反应体系中获得一个溶剂化电子,成为负离子自由基。后者再从反应液中获得一个电子,并生成1,4-双负离子,随后,从溶剂中夺取质子而得单烯产物。
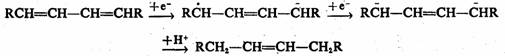
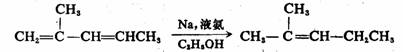
98%
孤立的碳碳双键不被金属-液氨试剂还原,因为初始生成的负离子自由基没有共轭的稳定作用,反应需要较高的能量。
2.芳烃可溶性金属的还原
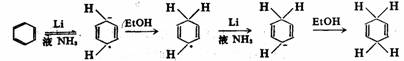
一种选择性还原芳烃的方法。用碱金属(锂或钠)的液氨溶液的还原称为伯奇(Birch)
还原,反应历程与共轭二烯的可溶金属法还原相同,表现为溶剂化电子的1,4-加成,生成非共轭的环己二烯:
在伯奇还原中,芳环上已有的取代基对产物影响很大。环上的吸电子基团由于可稳定负离子中间体,从而可促进还原的进行,并且在形成的中间体中,以吸电子基直接同负电荷相连占优势,其还原产物为1-取代-2,5-环己二烯衍生物:
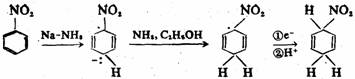
供电子基团由于不利于负电荷的分散而使反应难于进行,并且在形成的负离子中间体中,供电子基团与负电荷或单电子尽可能远离时,对反应比较有利。这时产物为1-取代-1,4-环己二烯衍生物。

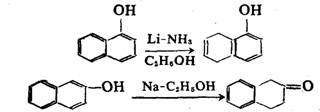
α-萘酚和β-萘酚的伯奇还原产物显著不同。前者在不含羟基的环上进行反应,后者则在含羟基的环上进行。这种差异可能也是由于中间体稳定性不同的关系。
共 4 页
1 2
3
4 |