|
第三节
氧
化
反
应
有机分子的加氧或脱氢过程称为氧化反应。在官能团的转换中,通过氧化反应可得较高氧化态的有机化合物。因此氧化反应同还原反应一样,是有机合成研究和工业生产中最常用、最重要的反应类型之一。
氧化反应是通过氧化剂来实现的。最常用的氧化剂是6价铬和7价锰的含氧衍生物。它们氧化能力强,但选择性较差,是通用氧化剂。有些氧化剂如SeO2、Pb(OAc)4等只能有选择地氧化某些基团,是专用氧化剂。
氧化反应的机理复杂多样,许多迄今仍不很清楚,因此,氧化反应难以按机理进行分类讨论,这一节仍按官能团的类型进行介绍。
一般氧化剂可分成三类:过渡金属衍生物,氧、臭氧及过氧化物,以及其它氧化剂。它们通常为亲电试剂。反应中氧化剂从被氧化物中夺取电子而还原。氧化反应的选择性同氧化剂种类、反应条件有关。
一.非官能团碳原子的氧化
烷烃很难氧化。在剧烈条件下,铬酸、高锰酸钾等强氧化剂能将烷烃氧化成酮和羧酸的混合产物。其中伯、仲、叔碳被氧化的相对速率大致是1∶100∶1000。虽然烷烃的氧化不是一个好的合成转换,但在工业制备上仍有一定意义。例如,来源丰富的石蜡等高级烷烃,在KMnO4、MnO2等催化下,用空气或氧气氧化,可制得高级脂肪酸。
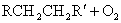 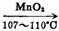
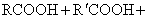 其它羧酸 其它羧酸
其中 的脂肪酸可代替动植物油作肥皂,这样可节省大量食用油。低级烷烃,如 的脂肪酸可代替动植物油作肥皂,这样可节省大量食用油。低级烷烃,如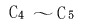 的烷烃在催化剂存在下控制氧化,可制
备乙酸、丙酮等基本化工原料。 的烷烃在催化剂存在下控制氧化,可制
备乙酸、丙酮等基本化工原料。
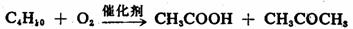
烷烃的叔碳-氢键能被铬酸或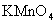 氧化成醇: 氧化成醇:
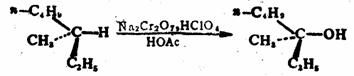
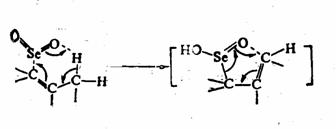
烯丙位的C-H键也能被氧化,生成醇或酮。常用的选择性氧化剂为二氧化硒(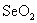 )。 )。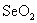 对烯丙位的氧化优先于碳-碳双键。反应的第一步是 对烯丙位的氧化优先于碳-碳双键。反应的第一步是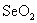 对碳-碳双键加成,产物为硒酸烯丙酯。后者水解为烯丙醇,再加 对碳-碳双键加成,产物为硒酸烯丙酯。后者水解为烯丙醇,再加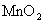 氧化,或将硒酸烯丙酯热解,则得α,β-不饱
和酮。 氧化,或将硒酸烯丙酯热解,则得α,β-不饱
和酮。
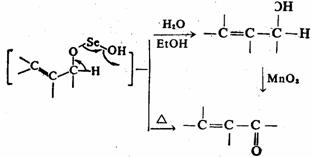
例如:
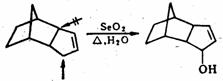
57%
羰基的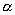 -C-H键也可被 -C-H键也可被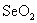 氧化成羰基。例如: 氧化成羰基。例如:
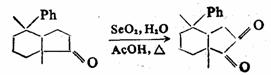
二.
碳-碳重键的氧化
烯烃双键可被多种氧化剂氧化,氧化剂不同,反应历程和氧化产物也不同,在合成上都很有用途。
烯烃双键可被过酸氧化为环氧化物。由于环氧化物是许多反应的合成中间体,故烯烃的环氧化应用十分广泛。反应被认为是过氧酸对双键的亲电进攻,双键上连有供电子基团时,可促进反应的进行:
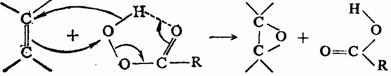
由上述反应历程可知,碳碳双键连有给电子基或过氧酸带有吸电子基时均可使环氧化的速度增加。不同过氧酸的活性次序是:过氧三氟乙酸>间氯过氧苯甲酸>过氧甲酸>过氧苯甲酸>过氧乙酸。末端单取代烯烃与大多数过氧酸的反应速度都很慢。
该反应具有较高的立体选择性,氧优先从分子位阻较小的一面进攻。
环氧乙烷衍生物经酸水解生成二醇,由构象固定的环己烷衍生物所生成的环氧化物开环时优先生成羟基处于双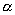 -键的反式产物: -键的反式产物:
无论环内环外双键利用冷的碱性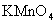 为氧化剂,仔细控制条件,可在温和的条件下,高产率地转化为顺式二醇: 为氧化剂,仔细控制条件,可在温和的条件下,高产率地转化为顺式二醇:
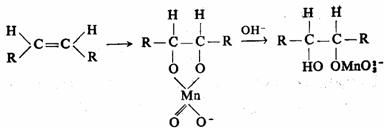
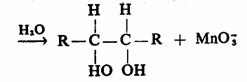
反应是按形成环状锰酸酯历程进行的,同位素o18研究表明氧是高锰酸根转移给生成物的。
双键在加热或酸性条件下用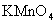 氧化,链烯双键断裂生成两分子羰基化合物,环烯则断裂为一分子二羰基化合物。如果双键碳上有氢原子,则产物为羧酸。这个反应可用于双键的结构剖析,但有时也可用于合成。 氧化,链烯双键断裂生成两分子羰基化合物,环烯则断裂为一分子二羰基化合物。如果双键碳上有氢原子,则产物为羧酸。这个反应可用于双键的结构剖析,但有时也可用于合成。
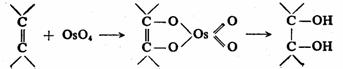
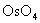 也是烯烃顺式羟基化的良好试剂,代替 也是烯烃顺式羟基化的良好试剂,代替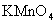 ,可避免生成的二元醇的进一步氧化,顺式二元醇的收率提高,但 ,可避免生成的二元醇的进一步氧化,顺式二元醇的收率提高,但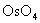 价贵且有毒。 价贵且有毒。
共 2 页 1
2 |