|
第一节 自由基取代反应
自由基取代反应是一类重要的和常见的自由基转移反应,主要是指烷氧基、烷基、苯基、过氧自由基以及卤原子的夺氢反应。现以烷烃的卤代反应为例,说明自由基取代反应的历程。
一.烷烃的卤代反应历程
1.烷烃的氯代反应历程
烷烃的卤代反应是卤原子夺氢的链锁反应,甲烷氯化的反应历程为:
(1)Cl2
→
2Cl·
(光照或加热)
(2)CH4
+ Cl· →
CH3·
+ HCl
(3)CH3·
+ Cl2 →
CH3Cl + Cl·
(4)Cl·
+ Cl·
→
Cl2
(5)CH3·
+ CH3·
→
CH3CH3
(6) CH3·
+ Cl· → CH3Cl
反应(1)是链引发步骤,产生链反应所需的自由基氯原子。除了光照引发外,还可以加热或用过氧化物、偶氮化合物等引发剂来引发。
反应(2)和(3)是链增长步骤。在反应(2)中卤原子夺氢,生成甲基自由基,在反应((3)中,甲基自由基和氯分子反应,生成氯甲烷,同时又生成氯原子。反应(2)和(3)的反复进行可以生成大量的卤代甲烷分子。
反应(4)、(5)、(6)中,自由基偶联成稳定分子,使链反应不能再继续下去,是链终止步骤。
产生的一氯甲烷再与氯自由基作用,生成二氯甲烷:
CH3Cl + Cl·
→
·CH2Cl
+ HCl
·CH2Cl
+ Cl2 →
CH2Cl2 +
Cl·
如此循环可得到三氯甲烷和四氯化碳。
2.卤素对甲烷的相反应活性
烷烃的卤代反应中,只有氯和溴具有适当的活泼性;氟代反应相当剧烈,难以控制;碘代反应难以发生,无实际意义。为什么卤素对甲烷的相对反应活性次序是F2>Cl2>Br2>I2呢?为了理解这个问题,必须首先明确反应历程中的定速步骤。现把卤代反应前三步(1)—(3)的反应热列举如下;
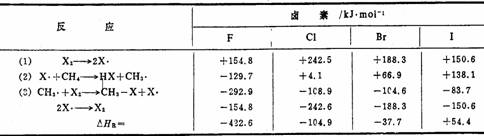
步骤(1)的能量是指均裂产生卤素自由基所需要的能量(即键能),其中氟和碘的离解能较小,氯和溴的都较大,显然这一步不是决定相对反应活性的关键。反应(3)都是放烈反应,氯、溴、碘的△H都非常接近;而且这一步骤与X-X键断裂有关,这与反应(1)有类似之处,所以这一步也不是定速步骤。如果反应(1)或(3)是定速步骤,其相对活性应该是I2>F2>Br2>Cl2,显然,这与实验事实不相符,所以关键步骤只能是反应(2),这一步骤的△H值差别很大,自氟的强烈放热反应到碘的强烈吸热反应,这与反应相对活性的次序是相符的。另外从同位素效应的实验结果也完全证明反应(2)即卤原子从甲烷分子中夺取氢生成甲基自由基一步是反应的定速步骤。由以上讨论可见,氯代反应和溴代反应活性比较适中,反应容易控制。两者的相对活性为Cl2>Br2。
由于碘原子和甲烷之间的夺氢反应的活化能很高(>33千卡/摩),反应难以传递下去,致链反应不能发生,同时碘原子易于重新结合成分子,这就阻止了碘代反应的发生。而氟代反应活化能很低,并放出大量的热,反应相当激烈,难以控制。
3.烷烃各种氢对同一卤素的相对活性
和甲烷一样,乙烷以上的烷烃或芳基取代烷烃也都可以发生卤代反应。例如,丙烷在25℃及光照下与氯反应生成1一氯丙烷和2一氯丙烷,两种产物的得率为43%和57%。
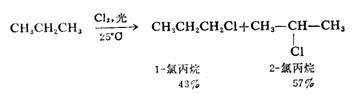
在丙烷分子中1°H有六个,2°H只有两个,如果1°H与2°H的活性相同,那么,夺取1°H的几率应该是2°H的三倍。即1—氯丙烷与2—氯丙烷得率之比应是3:1,而实际上则不是这个比例。以1°H的反应活性作标准为1,计算2°H的活性为4,
这就是说1°H和2°H的反应活性是不同的,2°H的反应活性相当于1°H的4倍。
异丁烷在四氯化碳中氯化,得到36%叔丁基氯和64%异丁基氯
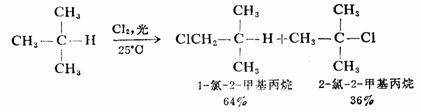
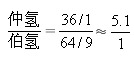
由此可以看出,不同类型的氢被氯取代的活性顺序为30H>2°H>1°H,活性比为5.1:4:1。实验结果还表明,叔、仲、伯氢的这种相对活性基本上与烷烃的结构无关。
共 2 页 1
2 |