|
第三节 共振论
共振论是二十世纪三十年代美国化学家
鲍林(L.Pauling)提出的。随着化学事实的积累,用单一结构式表示分子结构的经典结构理论遇到了挑战。有些分子(后来称为离域体系),经典的结构式并不能完全正确地反映一个化合物的真实结构及其性质,而且一个化合物往往可以写出不止一个经典结构式,最典型的例了就是苯,其结构用凯库勒结构式表示可以写为(Ⅰ),也可以写成(Ⅱ)。

但都不能完全反映苯的真实结构,实际上,苯没有单双键之分,键长都为0.139nm,其邻二取代物只有一种,而且苯具有特殊的稳定性,典型的化学反应不是烯烃的加成反应,而是取代反应。
再如,羧酸根的两个碳氧键是等长的,等等。总之,用一个价键结构式来描述分子的性质,已显得越来越有矛盾了。鲍林为了解决这些矛盾,根据经典结构理论的基本构想而作出了重要扩展,即不是用单一的结构式而是用两个或多个结构式来表示一种物质的结构。简单地说,这就是共振论。
一.共振论的基本内容
共振论认为一个真实的物质(分子或离子)的结构不能用单一的路易斯结构式描述时,可用多个路易斯结构式来描述,物质的真实结构是这些不同的可能结构式的叠加,是共振于这些不同的可能结构式之间的。这些可能的路易斯结构式被称为极限结构或正则结构,极限结构式的叠加得到共振杂化体,共振杂化体才能确切地反映分子的真实结构。用双箭头表示共振符号,苯的结构可用如下共振来表示:
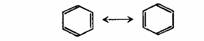
在上面苯的共振结构中,每一个路易斯结构式是一个极限结构式,但任何一个单独的极限结构式都不能完全正确地反映苯分子的真实结构,所有这些极限结构式的叠加,介于这些可能结构式之间,即共振杂化体才能代表苯分子的真实结构。
共振能是共振论的重要内容。真实物质(共振杂化体)的能量与最稳定的极限结构之间的能量差称为共振能。共振能可以通过量子化学方法进行计算,但是,一般来说它的经验值可由热化学方法或从氢化热的测定中推导出。例如苯的共振能,从原子形成气态分子时的生成热,可从它的燃烧热3304.2kJ/mo1和其燃烧产物(水和二氧化碳)的生成热算出来,结果是5539.1kJ/mol。而6个C—H、3个C=C和3个C—C的键能总和是5384.2kJ/mol,两者之差是154.9kJ/mo1,这就是苯的共振能。
一般来说共振能越大说明该物质比最稳定的共振结构稳定得越多。在经验上能画出的共振结构越多,则共振能相对的也越大。例如,从苯、萘、蒽和菲四个化合物的共振结构数目的比较中可以看出,共振结构数越多,则共振能就越大。苯有两个共振结构,其共振能为154.9kJ/mo1,萘有三个共振结构,其共振能为314kJ/mol,蒽有四个共振结构,其共振能为439.6kJ/mol,
菲有五个共振结构,其共振能为460.5kJ/mol
。
二.书写极限结构式遵循的主要原则
应用共振论,首先要写出共振结构式。书写极限结构式应遵循如下原则:
(1)一切极限结构式必须是正确的路易斯结构式,必须符合书写路易斯结构式的规则
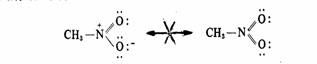
在后面的结构式中N原子的价层占有度是9,超过了8。
(2)同一化合物分子的所有极限结构式,仅仅是在电子排列上的不同,核的位置是固定不变的,即遵守各极限结构的核不改变的原则。例如:
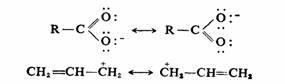
共 2 页 1 2 |