|
下面的变化是不同结构的变化,是不同化合物之间的动态平衡,决不是共振。

(3)同一化合物分子的一切极限结构式必须保持相同数目的成对电子(或未成对的孤电子)。如下的共振不存在:

但电荷分离的共振是可以的:
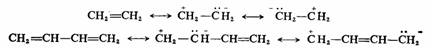
因为 上述的各组结构式之间没有未成对的孤电子或成对电子数目的变化。
(4)同一化合物分子的不同极限结构式的贡献大小并不一样,一般等价共振(共价键数目相等的共振)比不等价共振重要,而且共价键多的极限结构比共价键少的更稳定,贡献也更大;含有电荷分离的极限结构不如没有电荷分离的贡献大,而且不遵守电负性原则的电荷分离极限结构通常是不稳定的,贡献很小,一般可以忽暗不计。例如:
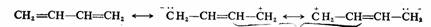
贡献较大
贡献较小
三.共振论应用举例
共振论在有机化学中的应用非常广泛,可以在有机化学的各个领域找到它的足迹。下面仅举几例以说明如何应用共振论。
1.对键长的影响
大家都知道,C—C单键的键长是0.154nm,C=C双键的键长是0.134nm,然而苯的六个碳碳键的键长是相等的,0.139nm。就是因为苯存在如下共振:

羧酸根可以写出下面的共振结构,所以两个碳氧键是等长的。
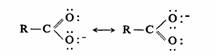
1,3丁二烯中C2—C3之间的键长不等于0.154nm,而是0.1466
nm,也是因为有下列共振,有后面一个极限式的贡献,使C2—C3之间的键长变得短一些。

2.对化学性质得影响
例如,当苯环上有羟基、氨基时,为什么亲电取代以邻、对位产物为主?苯酚和苯胺分别存在如下共振:
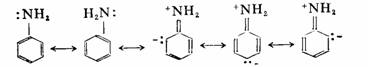
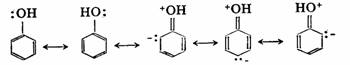
由于有后三个极限式的贡献,苯环邻、对位电荷密度较大,引入亲电基团进入邻、对位更有利,所以羟基、氨基是邻、对位定位基。
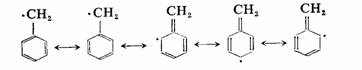
烯丙基自由基和苄基自由基可以写出如下的共振结构,使得自由基得到稳定:
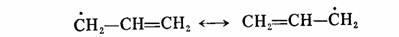
氯原子的电负性大于碳,使苯环上的电子云密度降低,氯苯的亲电取代反应活性比苯低,但氯原子又是邻、对位定位基,是因为有如下的共振(X为氯原子):
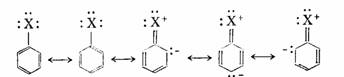
以上几例可说明,应用共振论说明问题比较直观、简明。
共
2 页 1 2
上一节
下一节 |