|
第二节 共价键
共价键概念是首先由路易斯于1916年提出的,直到现在,关于化合物结构的描述还是以路易斯的结构式为基础的。直到1927年海特勒(Heitler)和伦敦(London)利用薛定谔(Schrodinger)方程处理氢分子,才为价键理论的发展建立了量子力学基础,标志着价键理论的诞生。价键理论和分子轨道理论都是建立在量子力学的基础上的,都是量子力学的不同的近似处理,它们相辅相成,是当前阐明共价键和分子结构应用最普遍的两种方法。
一.价键理论
价键理论也叫电子配对法,简称VB法,即化学键的形成是由于原子间电子对共用的结果,这样的化学键称为共价键。
1.价键理论的基本观点
价键理论是量子力学近似处理氢分子结果的推广,认为成键原子彼此靠近时,各自具有的反平行自旋的未成对电子,偶合配对达到电子对共用,使体系能量降低,而形成稳定的共价键。所以把价键理论也叫电子配对法。
自旋反平行的成对电子的偶合所以能降低体系能量而成键,可以看做成键原子的原子轨道相互作用的结果。成键原子彼此接近到一定距离时,各自的反平行自旋的未成对电子不仅围绕自身原子轨道运转,而且受对方原子核的吸引并绕其原子轨道运转,这样相互作用的结果,体系能量下降而键合。这是以薛定谔方程近似处理氢分子得到的结论。一般常把电子对的共用称为轨道交盖或电子云重叠。
价键理论认为一个原子如果有几个未成对电子,就可以与几个自旋反平行的电子配对成键,因而一个原子有几个未成对电子,其化合价就是几。同时认为一个电子既与另一个电子配对,就不能再与第三个原子的电子配对,这称为共价键的饱和性。共价键也常常具有方向性,因为除s轨道为球形对称之外,所有原子轨道都具有一定的取向。而当原子轨道交盖成键时,轨道交盖越多则形成的共价键越牢固,因此共价键的形成必然采取可能范围内交盖程度最大的方向交盖成键,所以共价键有方向性,生成的分子也必然具有一定的立体构型。
2.轨道杂化
价键理论在应用于具体问题时还存在一些矛盾,如碳原子在基态时的电子层结构为:1s2
2s2 2px1 2py1,只有两个2p轨道填充了电子,是未充满的轨道,各有一个未成对电子,碳原子应为两价。但实际上碳原子主要表现为四价,而且如在甲烷中,并无s轨道和p轨道之别,四个键是等同的。后来,鲍林(L.Pauling)提出了杂化轨道(hybrid
orbitals)的概念。
原子在化学反应过程中,为了有利于体系能量的降低,形成更稳定的化学键,趋向于将原来不同的原子轨道通过线性组合,重新组合为新的原子轨道,这样的过程称为轨道的杂化,而经杂化后的原子轨道称为杂化轨道。如甲烷中的碳原子在成键时,一个2s电子激发到2pz轨道上,而后线性组合为四个相等的轨道,称为sp3杂化轨道。
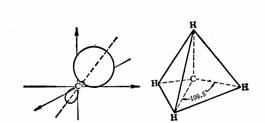
sp3杂化轨道和甲烷的四面体构型
sp3杂化轨道是由一个球形对称的、没有取向的s轨道和三个互相垂直的、具有方向性的p轨道混合组成的。电子云偏向一端,增加了轨道的成键能力,有利于交盖成键。四个sp3杂化轨道的对称轴在成键时,由于电子对相互排斥的结果,形成四面体的立体构型,对称轴指向四面体的四个顶角,如果成键原子相同(如甲烷),则为正四面体,键角109.5º,这已经用物理方法测定加以证实。
共 6 页 1 2 3 4
5
6 |