|
3.σ键和π键
轨道头对头交盖所构成的键为σ键。σ键是以原子核连线为对称轴,在成键两原子核之间,轨道呈圆柱形对称而交盖的,交盖比较充分,键相对牢固。而且σ键沿键轴相对旋转不会影响键轴上电子云的分布,因此σ键可以自由旋转。在双键或叁键中的π键则不然,它是由p轨道肩并肩从侧面交盖而形的,p轨道的对称轴必须相互平行才能充分交盖,所以π键不能自由旋转,而且π键相对较弱,可极化性较大,这是π键的特性。
二.分子轨道理论
价键理论由于延用了经典的路易斯结构和电子配对的概念,比较直观、形象、容易被接受,但因是以定域概念为基础,具有明显的局限性。例如对1,3-丁二烯、苯等离域键的描述是比较困难的,不得不引入比较抽象的共振概念。而对O2分子的结构及其顺磁性、则无法用价键理论作出解释。
分子轨道理论则与价键理论不同,它不再把化学键定域在成键原子之间,而认为分子轨道是成键原子的原子轨道相互影响、相互作用、重新组合的结果,价电子是围绕着整个分子,运动于整体的分子轨道之中的。这样,分子轨道也就是电子在整个分子中运动的状态函数。
1.分子轨道理论的基本内容
分子轨道(MO)通过原子轨道的线性组合而得到(一般简称LCAO),通常以函数ψ表示分子轨道,即分子中电子运动的状态函数,或以ψ2表示,ψ2dτ表示分子中电子在微体积dτ内出现的几率,ψ2则为几率密度,常称为电子云密度。如氢分子根据原子轨道的线性组合可以组成如下:
ψ=c1φ1+c2φ2
ψ*=
c1φ1-c2φ2
其中φ1和φ2是两个氢原子的原子轨道,相加得到的是能量较低的成键轨道ψ,而相减得到的是反键轨道ψ*,能量较原子轨道为高,如下图所示。
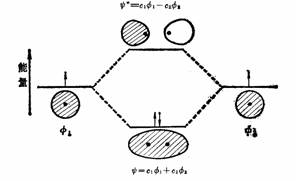
氢分子轨道的线性组合
有几个原子轨道,就可以组成几个相等数目的分子轨道,每个分子轨道最多可以填充自旋方向相反的两个电子。分子轨道的能量可以通过薛定谔方程计算
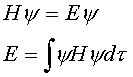
分子的总能量 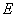 为电子占有的分子轨道的能量 为电子占有的分子轨道的能量
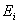 的总和,即 的总和,即
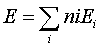
式中 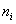 为 为
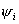 轨道上的电子数目,每个分子轨道由几个电子占据, 轨道上的电子数目,每个分子轨道由几个电子占据,
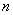 就是几,可以是0,也可以是1或2。分子的总能量实际是分子稳定性的标志。氢分子的分子轨道也可以能级示意图表示。 就是几,可以是0,也可以是1或2。分子的总能量实际是分子稳定性的标志。氢分子的分子轨道也可以能级示意图表示。
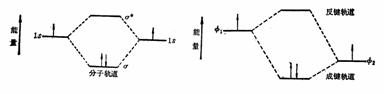
氢分子轨道能级示意图 非简并原子轨道组成的分子轨道能级示意图
每个分子轨道都各具有其相应的能量,分子中则有许多不同能级的分子轨道,电子在这些分子轨道中的分布,与电子在原子的原子轨道中的分布相似,也同样是根据能量最低原理、保里(pauli)原理和洪特(hund)规则进行填充。填充后如果体系能量降低,则稳定成键。一般,在基态时电子只占有成键轨道,反键轨道通常是空着的,只有在激发态时电子才占有反键轨道。
不同能级的原子轨道(非简并的)也可以组合为分子轨道,但能量差不能太大,一般相近能级的原子轨道才能有效地组成分子轨道。
除了s轨道,其他原子轨道、杂化轨道也可以组成分子轨道,但必须对称性匹配,或者说位相相同,即符号相同才能相互交盖组合为分子轨道。
共
6 页 1
2 3
4 5
6
|