|
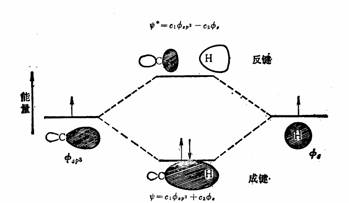
S轨道和SP3杂化轨道组成的分子轨道
P轨道可以头对头组合成σ分子轨道,也可以肩并肩交盖而组合成π分子轨道。
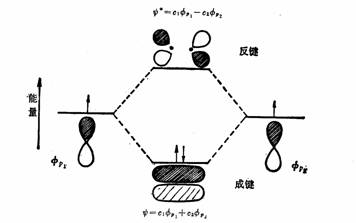
P轨道组合成π分子轨道
由一对自旋反平行的电子占有分子轨道构成的键是双电子键,由一个单电子占有分子轨道构成的键叫单电子键,如氧分子的成键情况就含有单电子π键。这从价键理论不好解释,而按分子轨道理论是很容易理解的。如下图所示,余下的两个电子,根据洪特规则只能分别填充到两个简并的π*轨道上,而且是自旋平行的,因此氧分子表现为顺磁性。
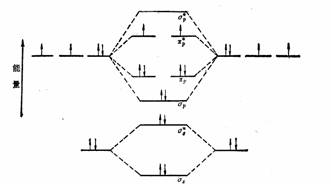
氧的分子轨道
2.休克尔(Hǔckel)分子轨道法
通过薛定谔方程求解分子轨道系数和计算轨道能量是非常复杂的,一般只采用近似的方法进行处理。其中比较简单、也是在描述π电子体系时经常用到的近似法就是休克尔分子轨道法,简称为HMO法。
利用休克尔分子轨道法近似求解薛定谔方程,可以得到分子中π电子体系的总能量,个别分子轨道的能量和分子轨道线性组合中原子轨道函数的系数。在此我们不讨论一系列的数学计算,主要介绍其结论和应用。
如乙烯分子中碳原子以SP2杂化成键,构成五个σ键,这些σ键组成共平面骨架,而π体系的P轨道组合为两个分子轨道:
ψ=c1φ1+c2φ2
ψ*=
c1φ1-c2φ2
以α代表碳原子2P轨道的能量,以β表示相邻原子轨道相互作用的能量(由于考虑的只是SP2杂化碳原子P轨道构成的π体系,α和β可近似视为常数),采用休克尔分子轨道法近似计算,成键轨道ψ能量为α+β,而反键轨道ψ※的能量α-β,在基态时,两个P电子在成键轨道,总能量E=2(α+β)。
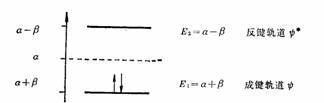
因为
P电子的能量为α,π键的键能可以简单地计算为:
Eπ=2(α+β)-2α=2β
对于1,3-丁二烯,根据HMO法计算,四个2P轨道线性组合四个分子轨道,其能量计算为:
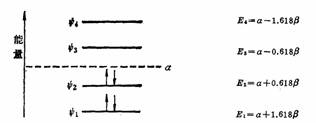
基态时地总能量
E=2E1+2E2=2(α+1.618β)+2(α+0.618β)=4α+4.472β
如果按两个孤立π键计算,总能量应为4α+4β(乙烯的两倍),两者相差0.472β,这个能量是1,3-丁二烯特殊的稳定能,是由于电子离域的结果,称为离域能或共轭能。
共 6 页 1
2
3
4
5
6 |