|
这样,碳原子进行sp3杂化的结果是形成了四个相等的杂化轨道,构成了四个相等的杂化轨道,构成了四个键而不是两个键。同时加强了轨道的方向性,为轨道有效地交盖形成稳定的化学键创造了更加有利的条件。虽然2s电子的激发和轨道的杂化需要能量,但由形成两个键而变为形成四个键,又是更强的键,所释放的能量完全可以补偿而有余。
在烯烃和炔烃中,碳原子只与三个或两个原子或原子团相连成键,这样情况下碳原子可以按其他形式杂化,即sp2杂化或sp杂化。由一个2s轨道和两个2p轨道进行杂化组成三个相等的sp2杂化轨道,其对称轴在同一平面,互为120º角而指向等边三角形的三个顶点。余下一个2p轨道,其对称轴垂直sp2杂化轨道对称轴所在的平面,在成键时两个碳原子的p轨道相互平行侧面交盖形成π键,乙烯中即如此。
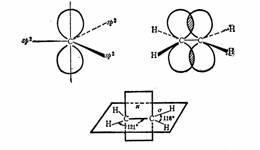
SP2杂化和乙烯中的π键
由一个2s轨道和一个2p轨道则组成sp杂化轨道,其对称轴互成180º角而成一直线,余下两个2p轨道,其对称轴都垂直于sp杂化轨道对称轴所在的直线,而且相互垂直。在成键时,这两个p轨道可以从侧面平行交盖构成两个π键,如在乙炔中就是这样。
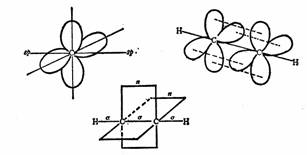
SP杂化和乙炔中的π键
从上面的讨论可以看出,成键原子的杂化状态决定了成键后化合物分子的立体构型。成键原子的杂化状态也影响物质的性质,在杂化轨道中,S成分越多,杂化轨道越靠近原子核,因此杂化轨道半径越短,杂化轨道的电负性越大。
轨道的杂化并不都是这样典型和规律的,除非杂化碳原子所连接的都是相同原子或原子团,不然都会存在一定的偏差。例如氯甲烷的H-C-H键角实际为110º,而Cl-C-H键角为108º,都不是正四面体的109.5º角。这样的偏差可以认为是由于价电子层成键电子对相互排斥作用力的所造成的。成键电子对由于相互排斥的结果,彼此尽可能远离,而在氯甲烷中,由于氯原子相对于氢原子有较大的电负性,在C-Clσ键中电子云密度的分布更远离碳原子。C-Clσ键上的成键电子对是不对称的,与C-Hσ键上的成键电子对比较,距离碳原子核要远些,因此C-H键与C-H键上的成键电子对之间排斥力要大于C-H键与C-Cl键上的成键电子对之间的排斥力,所以H-C-H键角变大而Cl-C-H键角相应变小。这种情况也可以认为是碳原子的杂化状态轻度变化的结果。与p轨道相比,s轨道中的电子更靠近碳原子核,p轨道中的电子则相对远离碳原子核。C-Cl键中成键电子对与C-H键比较远离碳原子核,也就是与氯原子成键的杂化轨道中增加了p轨道的成分,不是25%s成分和75%的p成分,而p成分更多些,计算结果是与氯成键的碳原子杂化轨道实际为sp3.1。但碳原子基态时的轨道总数是一定的,一个s轨道和三个p轨道,因此,氯甲烷中C-H键上碳原子的杂化轨道则应近似于sp2.9。这样氯甲烷的中心碳原子就不是纯的sp3杂化,可用以校正理想的杂化状态与实际存在的偏差。
同样是由于不等性杂化的结果,在未共用电子对所处的杂化轨道中,电子对更靠近中心原子的原子核,具有较多的s成分,因此电子对之间的排斥力增加,键角增大。在水和氨分子相应的O-H键和N-H键中,成键电子对所处的轨道比较远离中心原子核,具有较多的p成分,所以H-O-H键角和H-N-H键角与正常键角109.5º相比,势必相应变小。

共 6 页 1
2
3
4
5
6 |