|
第四节 碳
烯
碳烯也叫卡宾(carbenes),
是亚甲基及其衍生物的总称。其中心碳原子为中性两价碳原子,包含六个价电子,四个价电子参与形成两个σ键,其余两个价电子是游离的。最简单的碳烯为:CH2,也称为亚甲基。
一.碳烯的生成
碳烯的生成主要通过两个途径,一是在光或热的作用通过某些化合物的自身分解反应;二是在试剂的作用下,某些化合物经α-消除反应而得到碳烯。
1.分解反应
重氮化合物通过热或光分解,失去氮分子而生成相应的碳烯,例如重氮甲烷的热或光分解:
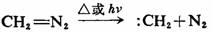
这是实验室产生:CH2的常用方法,也是制备碳烯的一般方法。但烷基重氮化合物不稳定,而且容易爆炸。为了制备烷基取代的碳烯,可以不用易爆炸的重氮烷作反应物,而是由醛或酮生成的腙通过氧化、再分解得到。
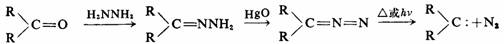
烯酮在光或热的作用下分解也可制备相应的碳烯,例如:
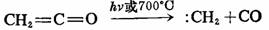
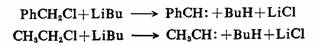
2.α-消除反应
在第九章的第二节将对α-消除反应作了较详细的讨论,这里不再重复。α-消除反应是制备二卤碳烯的基本方法。甲基碳烯和苯基碳烯可由乙基氯和苄基氯来制备,但必须以烷基锂作为强碱来反应。反应也是α-消除反应。
二.碳烯的结构
碳烯的中心碳原子只有六个价电子,是两价化合物,只与两个其他的原子或基团相连接。四个价电子为成键电子,占用碳原子的两个原子轨道,构成两个σ键,还余下两个未成键的价电子。正常状态下,中心碳原子还剩余两个原子轨道,可以容纳未成键的电子,在这种情况下剩余价电子的排布方式有两种可能。一种可能是两个未成键电子同处于一个轨道,其自旋方向相反,而另一个轨道是空的,处于这样状态的碳烯称为单重态(singlet
state)碳烯;另一种可能是两个未成键电子分别处于两个轨道,电子的自旋方向相同,处于这种状态的碳烯称为三重态(triplet
stante)碳烯。根据电子排布半充满的洪特 规则,三重态时,电子间排斥作用较小,能量较低。
单重态碳烯的中心碳原子近似于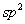 杂化状态,三个杂化轨道中,两个杂化轨道与其他原子或基团成键,另外一杂化轨道则为一对未成键电子占据,余下一个未参与杂化的 杂化状态,三个杂化轨道中,两个杂化轨道与其他原子或基团成键,另外一杂化轨道则为一对未成键电子占据,余下一个未参与杂化的 轨道是空的。 轨道是空的。

单重态的这种排布方式,使σ键与σ键之间,σ键与未成键电子对所处轨道之间,互呈近似120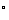 的键角,两对成键电子和一对未成键电子之间,相互的排斥力最小。这样的排布方式是单重态碳烯最合理的存在形式。从其结构特征不难看出单重态碳烯既显示具有未共用电子对的碳负离子特征,同时又表现具有空 的键角,两对成键电子和一对未成键电子之间,相互的排斥力最小。这样的排布方式是单重态碳烯最合理的存在形式。从其结构特征不难看出单重态碳烯既显示具有未共用电子对的碳负离子特征,同时又表现具有空 轨道的碳正离子的特性。而三重态碳烯的中心原子则近似于 轨道的碳正离子的特性。而三重态碳烯的中心原子则近似于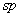 杂化状态,两个 杂化状态,两个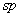 杂化轨道分别与其他原子或基团成键,余下两个未参与杂化的 杂化轨道分别与其他原子或基团成键,余下两个未参与杂化的 轨道彼此垂直,而且各容纳一个未成键的价电子。 轨道彼此垂直,而且各容纳一个未成键的价电子。
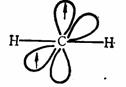
三重态碳烯以这样的排布方式为最合理,电子之间排斥作用最小。因此,三重态是线型结构,键角接近180 。由于三重态碳烯中每个 。由于三重态碳烯中每个 轨道只有一个电子,具有孤电子的性质,近似于双自由基。 轨道只有一个电子,具有孤电子的性质,近似于双自由基。
实际上,这样考虑单重态和三重态的结构是过于简单化了,根据计算和测定的结果,单重态碳烯的H-C-H键角为103 ;而三重态碳烯的H-C-H键角则为136 ;而三重态碳烯的H-C-H键角则为136 ,并非直线型结构,而是弯曲的。 ,并非直线型结构,而是弯曲的。

三重态碳烯与单重态烯比较,根据洪特规则,三重态碳烯的电子之间排斥作用较小,能量较低,是较稳定的结构,亚甲基单重态和三重态之间的能量差约为40kJ/mol左右。一般亚甲基及其烷基衍生物的基态为三重态,当连有带未共用电子对的取代基时(如—F、—Cl、—Br、—OR、—NR2),则单重态为基态。
三.碳烯的反应
碳烯是非常活泼的活性中间体,容易发生反应,由于是缺少电子的活性中间体,一般在反应中是以亲电性为特征的。其反应活性的次序大致为:

碳烯的典型反应主要有两类:π键的加成反应和σ键的插入反应(insertion
reactions)。
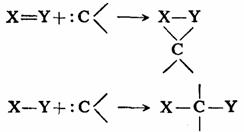
但其反应的历程和结果很大程度上依赖于碳烯未成键电子的自旋状态,是单重态还是三重态。
1.加成反应
碳烯与碳-碳双键加成生成环丙烷衍生物,这是碳烯最典型的反应之一。

由于碳烯以单重态或三重态参加反应的情况有区别,所以当反应条件不同时,其结果也不同。例如碳烯与2-丁烯的加成,如果在液态2-丁烯中,使重氮甲烷光分解而与2-丁烯反应,顺-2-丁烯只生成顺-1,2-二甲基环丙烷,而反-2-丁烯则只生成反-1,2-二甲基环丙烷。很明显,反应具有立体选择性,说明是协同反应,是一步完成的,π键打开,碳烯同时加到π键两端的碳原子上。在这种情况下,碳烯显然是以单重态参加反应的。
共 2 页 1
2 |