|
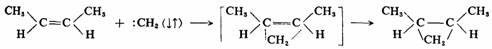
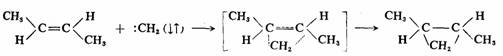
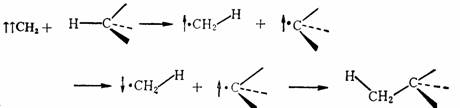
如果是在气态2-丁烯中,光分解重氮甲烷进行反应,则不论是顺还是反2-丁烯,都生成顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷的混合物,没有明显的立体选择性。在这种情况下,碳烯是以三重态参加反应的,是自由基的分步反应历程,第一步先生成双自由基,然后自旋翻转而后关环,这时C—C键的旋转要比电子自旋翻转和关环快,因此,双自由基在关环之前有足够时间绕C—C键旋转而达到平衡,所以竞争的结果必然产生两种构型的产物。
碳烯也可以与炔烃、环烯烃,甚至与苯环上的π键进行加成反应。例如:
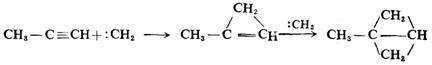
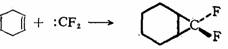
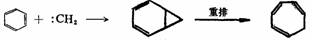
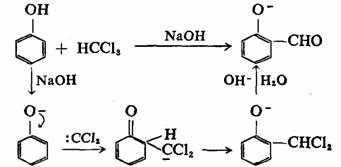
在苯环上,由于离域的影响,与π键加成比较困难,并不是所有碳烯都能与苯环加成,必须是足够活泼的碳烯,如:CH2、:CHCl可与苯环加成,而:CCl2一般不能与苯或甲苯在环上进行加成,只有当环上有强的供电基,电子云密度较高时才有可能。这就是瑞穆-悌曼(Reimer-Tiemann)反应。
2.插入反应
碳烯可以在C—Hσ键上进行插入反应,碳烯插到C—H键之间。这也是碳烯的主要反应之一,而且一般来说,在不同的C—H键上都可插入,因而在合成上意义不是很大。

不论单重态碳烯还是三重态碳烯,其插入反应得到的产物是相同的,但由于电子自旋状态的不同,存在着两种不同的反应历程。单重态碳烯的插入反应是按一步完成的协同反应历程进行。
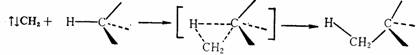
而三重态碳烯作为双自由基,反应是分步进行的,首先夺取氢原子,而后通过自由基偶联两步完成。
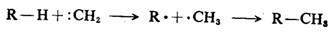
除了C—Hσ键可以进行插入反应之外,碳烯还可以在C—Br、C—Cl和C—Oσ键上进行插入反应,但C—C键不能,例如:
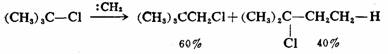
3.重排反应
碳烯可以发生分子内的重排反应,通过氢、芳基和烷基的迁移,生成更为稳定的化合物,这也是碳烯常见的反应。例如异丁基碳烯可以通过氢的1,2-迁移和1,3-迁移而重排为异丁烯和甲基环丙烷。
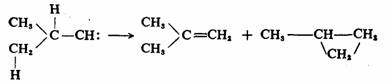
1,2-迁移 66% 1,3-迁移33%
这样的反应也可以看作分子内碳烯在C—Hσ键的插入反应,可以在α-C—H键上插入,也可以在β-C—H键上插入。
碳烯的重排反应中,在合成上具有实际应用价值的是沃尔夫重排反应。重排反应的机理一般认为是生成了酰基碳烯,而后重排为乙烯酮衍生物,因此是碳烯重排反应。该反应在第十章已进行了讨论。
4.碳烯络合物
上述碳烯的反应一般是通过产生游离碳烯的途径进行的。有些则不然,是通过生成一类碳烯与其他分子形成的络合物,通常为金属络合物而进行的,并不存在游离的两价碳烯。这些络合物严格讲并非活性中间体,但与碳烯相似,可以产生相同的反应结果,一般称为碳烯化物(carbenoids)或叫类碳烯(carbene-like)。例如:
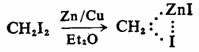
碳烯络合物
利用碳烯络合物,可以象碳烯一样与π键加成,得到与碳烯与π键加成同样的产物,而且具有高度的选择性,不可能与C—Hσ键发生插入反应,因而副反应较少,在有机合成上具有重要意义。例如把二碘甲烷和锌铜合金在乙醚的悬浮液中,加入含有C=C双键的化合物,其结果与碳烯反应相似,与C=C双键加成,而生成高产率的环丙烷衍生物。此反应通常称为西蒙-史密斯(Simmons-smith)反应。
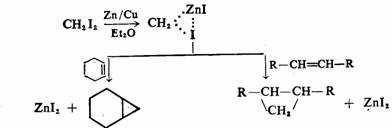
碳烯络合物的结构一般认为是由单重态亚甲基以空的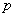 轨道与碘原子结合,而以 轨道与碘原子结合,而以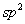 电子对与Zn结合的。反应历程一般认为是一步完成的协同反应,因而具有明显的立体选择性。 电子对与Zn结合的。反应历程一般认为是一步完成的协同反应,因而具有明显的立体选择性。
5.氮烯
氮烯也叫乃春(nitrenes),
是一价氮的活性中间体。最简单的氮烯为H—N:,也叫亚氮,可以把亚氮
H—N:看作氮烯的母体,其他氮烯为H—N:的衍生物。氮烯即H—N:及其衍生物的总称。
氮烯是碳烯的氮类似物,是某些反应中出现的活性中间体。氮烯的结构和反应与碳烯相似。氮烯也有单重态和三重态两种结构:

单重态
三重态
氮烯非常活泼,对它的研究还不是很充分。一般来说,芳基氮烯和酰基氮烯比较稳定。氮烯主要的反应也是与烯烃的加成反应和σ-键的插入反应。例如,与烯烃的加成反应,产物为氮杂环丙烷衍生物:
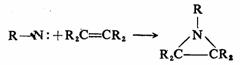
霍夫曼重排反应是酰基氮烯的重排。
共 2 页
1
2
上一节
下一节 |