|
第二节
芳环上的亲电取代反应
亲电取代反应是芳香化合物的典型反应。
一.亲电取代反应类型
在有机化学中,对亲电取代反应的介绍比较具体,再简单归纳如下:
1.卤代反应
亲电试剂为X+,是X2与催化剂三卤化铁作用生成的。反应活性CI2>Br2>I2。
2.硝化反应
亲电试剂为NO2+,硝酰正离子,由浓硝酸和浓硫酸作用生成:
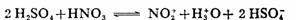
3.磺化反应
亲电试剂为SO3,
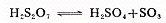
磺化反应是可逆的,例如在100~200℃之间,苯与73%硫酸可达到平衡
,如需得到磺酸可将生成的水蒸出。由于磺化反应具有可逆性,因此可用磺酸基来占据芳环上的某一个位置,利用它的定位效应,使别的取代基进入指定位置,然后再脱掉磺酸基。
磺化反应的邻位效应及速度和平衡控制在合成上也是有意义的。
4.付瑞德尔一克拉夫茨(Friedel-Crafts)烷基化反应及其相关的反应
付瑞德尔一克拉夫茨烷基化反应,简称付一克烷基化反应,是在芳环上导入支链的重要方法。卤代烷、烯烃和醇外,环醚也可以作烷基化试剂。工业上乙苯和异丙苯都是通过付一克烷基化反应制备的。亲电试剂是碳正离子,是由相应的烷基化试剂与AlCl3等路易斯酸或质子酸作用生成的,所以,付一克烷基化反应有烷基化试剂的重排产物。导入的烷基是致活基团,付一克烷基化反应常有多取代的副产物。
甲醛和氯化氢在无水氯化锌或三氯化铝的催化下与芳烃作用可把氯甲基直接引入芳环,称为氯甲基化反应。氯甲基可以转变成许多其它基团,该反应在有机合成上很有用。
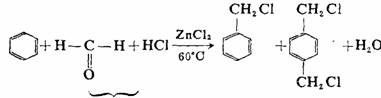
氯甲基化剂
70% 少量
5.付一克酰基化及其相关的反应
常用的酰化剂为酰氯、酸酐,其他的羧酸衍生物也可以起反应,但活性较低。进攻芳环的亲电试剂可能是酰基正离子或酰化剂与催化剂生成的络合物。
由于酰基使苯环钝化,在一般情况下只能导入一个酰基。烷基苯酰化时,产物中对位异构体较多。
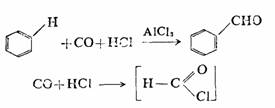
葛德曼-科赫(Gatterman-Koch)反应属于酰化型反应,在无水AlCl3的催化下,可在芳环上引入甲酰基,因此也称为芳环甲酰化法。反应历程认为是CO和HCl形成不稳定的甲酰氯,然后再反应:
6.与重氮化合物的偶联反应
重氮正离子是弱的亲电试剂,可与相当活化的芳环如芳胺或酚起反应,得到的偶氮化合物可作为合成染料中间体。
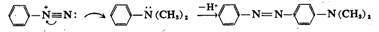

二.亲电取代反应历程
尽管反应的动力学、反应进程曲线对每一种亲电取代反应来说可能是不一样的,但大多数反应是按同一历程、相似的中间步骤而进行的,这就允许用一个亲电试剂E+来总的代表反应的一个组成部分,用
一个通式表示其历程。苯环亲电取代反应历程,除有效亲电剂的生成外,一般可归纳为两步或概括为加成一消除历程。首先是亲电子试剂E+近攻苯环与π电子体系形成π络合物,进而试剂与环上的某一个碳原子结合形成一个σ键,则得σ络合物。
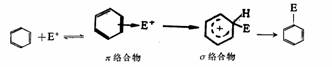
第二步是氢质子的离去形成产物,即重新恢复成芳香结构体系,从而完成了最后的取代过程。
E+与从苯环获得π电子,生成π络合物这种作用是很微弱的,并没有生成共价键。E+与从苯环获得两个电子,与苯环的一个碳原子形成σ键,生成σ络合物,苯环的环状共轭体系被破坏了,环上四个π电子离域在环的五个碳原子上,σ络合物是一个离域的碳正离子。
一般来说,π络合物的生成是可逆的,σ络合物的生成是不可逆的,且通常是反应的定速步骤。对多数反应来说,H+的离去比E+的离去容易得多,这些取代反应是不可逆的,但某些条件下,两者离去难易程度差不多,甚至E+的离去更容易些,则这一反应就是可逆的,如磺化、烷基化等反应。
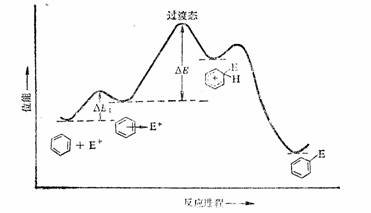
苯亲电取代反应进程-位能曲线图
本节共 2 页 1
2 |