|
6-5 试比较下列化合物或离子酸性的大小。
(ⅰ)2-甲基吡啶和3-甲基吡啶
(ⅱ)
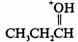 和
和
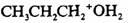
解 (ⅰ)考察2-甲基吡啶和3-甲基吡啶的共轭碱,共轭碱稳定的,则碱性弱,其共轭酸的酸性则强。
2-甲基吡啶的α-H在强碱的作用下生成的碳负离子具有如下共振结构:

N的电负性比C大,负电荷在N上,共振式较稳定。
3-甲基吡啶的α-H在强碱的作用下生成的碳负离子具有如下共振结构:

所有共振式的负电荷都在C上。
上述分析说明2-甲基吡啶的α位的负离子比3-甲基吡啶的α位的负离子稳定,碱性弱,共轭酸的酸性则强。
(ⅱ)用杂化效应解释。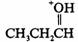 中氧SP2杂化, 中氧SP2杂化, 是SP3杂化。SP2杂化S的成分较多,氧上的未共用电子对在SP2杂化轨道中,离核较近,氧对未共用电子对的吸引力较大,未共用电子对质子的吸引力较小,酸性 是SP3杂化。SP2杂化S的成分较多,氧上的未共用电子对在SP2杂化轨道中,离核较近,氧对未共用电子对的吸引力较大,未共用电子对质子的吸引力较小,酸性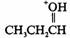 比
比
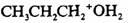 强。 强。
6-6
完成下述反应,写出反应历程。
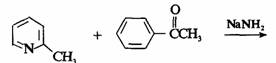
解
反应产物为:
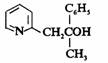
反应历程:
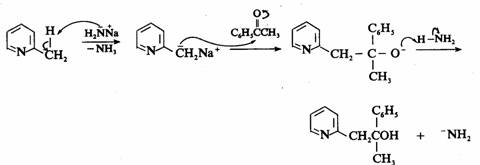
3-甲基吡啶不能发生上面的反应。
6-7
将下列两组自由基按稳定性由大到小的顺序排列。
(ⅰ)
a.
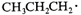 b.
b.
 c. c.
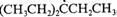 d. d.
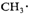
(ⅱ)
a.
 b.
b.
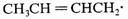 c.
c.
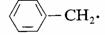
解 (ⅰ)c>b>a>d
(ⅱ)
b>c>a 它们的离解能分别是163.2kJ/mol 、200.8
kJ/mol、330.5 kJ/mol。
6-8
2- 甲基丁烷有3种C-C键,在热裂反应中可形成哪些自由基(一次断裂),推断哪一种断裂优先?
解 2-甲基丁烷
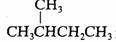 热裂可生成5种自由基,分别是
热裂可生成5种自由基,分别是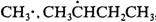 , ,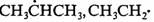 , ,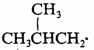 ,其中自由基 ,其中自由基
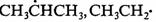 较为稳定,因此,生成自由基 较为稳定,因此,生成自由基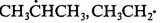 的断裂优先。 的断裂优先。
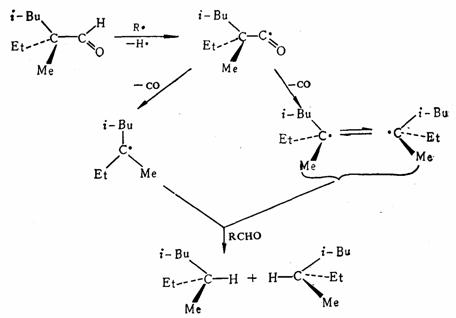
6-9 为下述反应提出一个合理的历程。解释为什么产物是外消旋体
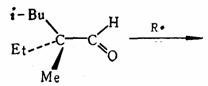 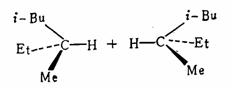
外消旋体
解 可能的反应历程如下。在自由基引发剂的作用下,反应物生成酰基自由基,失去CO,生成烷基自由基,从反应物夺氢
完成反应。
经电子自旋共振谱测定及其他物理方法证明,叔烷基自由基接近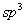 ,产物是外消旋体是由于棱锥构型可以翻转,如叔丁基自由基,是棱锥形构型,但构型翻转仅需2.5kJ/mol,能垒很低,在室温下既可迅速翻转,如同叔胺一样,分离不出来不同构型的异构体。产物是外消旋体不能说明叔烷基自由基是平面构型。 ,产物是外消旋体是由于棱锥构型可以翻转,如叔丁基自由基,是棱锥形构型,但构型翻转仅需2.5kJ/mol,能垒很低,在室温下既可迅速翻转,如同叔胺一样,分离不出来不同构型的异构体。产物是外消旋体不能说明叔烷基自由基是平面构型。
6-10
完成下面的反应式,并写出反应的可能历程。
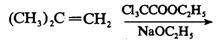
解
反应产物:
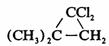
反应的可能历程:
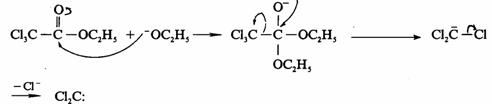
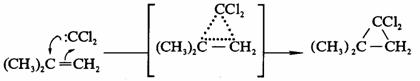
6-11
下列两个反应均发生环的扩大反应,根据所给的反应物和试剂,写出反应中间产物和环扩大的产物。
(ⅰ)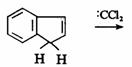 (ⅱ)
(ⅱ)
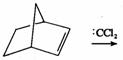
解
(ⅰ)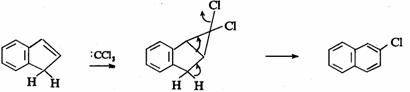
(ⅱ)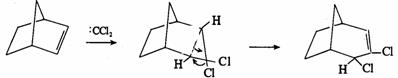
6-12
苯炔的结构是(1)而不是(2),为什么?
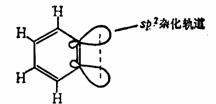
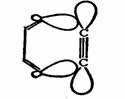
(1)
(2)
解
苯炔中的叁键碳原子仍为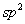 杂化状态,叁键的形成基本上不影响苯环中离域的π体系,苯环的稳定性保持不变,而新的“π键”是由两个 杂化状态,叁键的形成基本上不影响苯环中离域的π体系,苯环的稳定性保持不变,而新的“π键”是由两个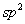 杂化轨道,在环平面内,侧面交盖而形成很弱的键,如(1)所示。这样的结构是与苯炔高度的化学活性一致的,也是经物理方法所证实的。在(2)中,两个叁键碳原子处于SP杂化状态,各以一个SP杂化轨道交盖形成一个σ键,又各以两个P轨道交盖形成两个π键,一个π键垂直于苯环平面,另一个π键平行于苯环平面。这样的碳-碳叁键是线型结构,键角180O。叁键碳原子的SP杂化轨道与环中其它碳原子的 杂化轨道,在环平面内,侧面交盖而形成很弱的键,如(1)所示。这样的结构是与苯炔高度的化学活性一致的,也是经物理方法所证实的。在(2)中,两个叁键碳原子处于SP杂化状态,各以一个SP杂化轨道交盖形成一个σ键,又各以两个P轨道交盖形成两个π键,一个π键垂直于苯环平面,另一个π键平行于苯环平面。这样的碳-碳叁键是线型结构,键角180O。叁键碳原子的SP杂化轨道与环中其它碳原子的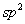 杂化轨道交盖成键时张力太大,而且也破坏了苯环的结构。显然这种结构是不大可能的。 杂化轨道交盖成键时张力太大,而且也破坏了苯环的结构。显然这种结构是不大可能的。
6-13
完成下列反应。
(ⅰ)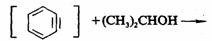 (ⅱ) (ⅱ)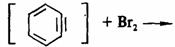
(ⅲ)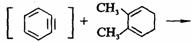
解 (ⅰ)苯炔的亲核加成,产物为
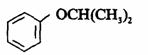
(ⅱ),苯炔的亲电加成 ,产物为
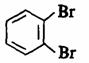
(ⅲ)
苯炔的环加成,产物为
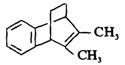
共 2 页
1 2
下一章 |