| 第十章 电解及库仑分析法 |
2. 阴极电位的选择
溶液中存在两种以上可沉积的离子时,进行电解就应考虑干扰和分离问题。如果两种金属离子的还原电位相差较大,可用控制阴极电位电解法使两种金属分离。例如,溶液中有A、B两种金属离子,其电解电流与阴极电位(i-Ec)曲线如图10-6 所示。图中a、b两点分别为A、B两种金属离子的析出电位。只要将阴极电位控制在ab之间进行电解,如图中d点,就可以使A离子定量析出,而B离子仍然保留在溶液中,从而实现A、B离子的分离和A离子的测定。待A离子测定完毕后,再将阴极电位控制在c点进行电解,就可以实现对B离子的测定。
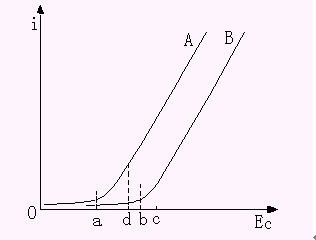 |
| 图10-6 分离A、B两种离子的i-Ec曲线 |
应用控制阴极电位电解法对铜、铋、铅、锡四种共存离子进行分离和测定就是一个很好的例子。在中性的酒石酸盐溶液中,阴极电位为-0.2V(相对于甘汞电极)时,铜首先析出。经称量后,再将镀了铜的电极放回溶液,在-0.4V电位下电解,使铋定量析出。再将阴极电位调节到-0.6V电解,此时铅定量析出。然后,酸化溶液,使锡的酒石酸络合物分解,在-0.65V阴极电位下电解,锡就定量沉积下来。显然,只要阴极电位控制得适当,就能很容易地定量测定多种离子化合物中的某一种离子。
3.电流-时间曲线 在控制电位电解过程中,由于被测离子在阴极上不断析出,电流随着时间增长不断减小,在某金属离子完全析出后,电流应降至零。但由于残余电流的存在,电流最后达到恒定的背景电流值,见图10-7。对于仅有一种离子在电极上还原,电流效率为100%时,电流和时间的关系为it=i0.10-kt(10-7)
式中it为t时的瞬时电流;i0为初始电流;k为常数,它与电极表面积、溶液体积、搅拌速度以及电极反应类别等因素有关。
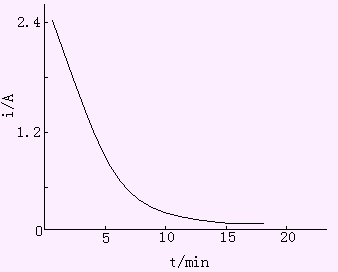 |
| 图10-7 控制阴极电位电解的i-t曲线 |
| 4.特点及应用 由于控制阴极电位能有效地防止共存离子的干扰,因此选择性好。该法既可作定量测定,又可广泛地用作分离技术,常用于多种金属离子共存情况下某一种离子含量的测定。这种方法的一些应用实例列于表10-2。 |
| 表10-2 控制电位电解法应用实例 |
 |
| 上一页 |