| 第十章 电解及库仑分析法 |
库仑分析法(Coulometry)是在电解分析法的基础上发展起来的。它是根据电解过程中消耗的电量求得被测物质的含量。
电重量法和库仑分析法的共同特点是:分析时不需要基准物质和标准溶液,它们是一种绝对分析方法,并且准确度极高。电重量法只能用来测定高含量物质,而库仑分析法特别适用于微量、痕量成分的测定。
第一节 电解分析法
一、 电解分析的基本原理
(一)电解现象
电解是指直流电流通过某种电解质溶液时,在电流的作用下电极溶液界面发生电极反应,从而引起溶液中某种物质分解的过程。例如在硫酸铜溶液中,浸入两个铂电极,电极通过导线分别与直流电源的正极和负极相连接(图10-1)。如果在两电极间有足够大的电压,则可观察到有明显的电极反应:
阴极反应:Cu2++2e=Cu↓
阳极反应:2H2O=4H++O2+4e
于是阳极上有氧气放出,阴极上有金属铜析出,形成金属镀层。
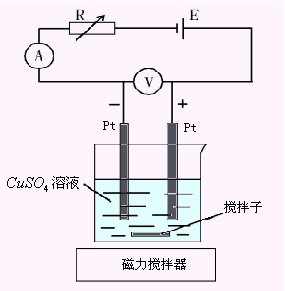 |
| 图10-1 电解装置 |
在电解时,能够使被电解物质在两电极上产生迅速、连续的反应,所需的最低外加电压称为分解电压。当以很小的电压加于电解池,起初没有电流通过。调节电阻R使外加电压增加,则电流略有增加。当达到某一定电压值时,如图10-2中D点,通过电解池的电流有明显的增加,同时在两电极上产生连续不断的电极反应,以后电流随电压的增加而直线上升。D点的电压就是分解电压。一种物质的分解电压对于可逆过程来说,在数值上等于它本身所构成的自发电池的电动势。在电解池中,此电动势称为反电动势。反电动势的方向与外加电压的方向相反,它阻止电解反应的进行。
例如,电解硫酸铜溶液,开始时并不构成自发电池。当接上外电压后,如外电压很小,在最初瞬间会有及少量的Cu和O2分别在阴极和阳极上析出。当一旦有少量的Cu和O2被吸附在电极上时,就立刻形成由氧电极和铜电极组成的自发电池,产生反电动势,阻止电解进行。只有当外加电压达到能克服此反电动势时,电解才能开始进行,电流才能显著上升。所以,要使某一电解过程能够进行,只有当外加电压超过(即使是很微小的数值)它自身构成的自发电池的电动势,也就是它的分解电压时,电解在理论上才成为可能。如以i表示电解电流,R表示电解池内阻,E表示分解电压,Ud表示理论分解电压,则外加电压U与Ud有如下关系:
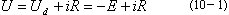 |
|
| 下一页 | |