| 第十章 电解及库仑分析法 |
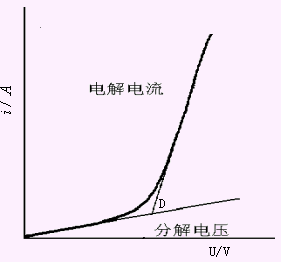 |
| 图10-2 电解铜(II)溶液的i-U曲线 |
在上例中,铜电极为阴极,氧电极为阳极,其阴极平衡电位Ec和阳极平衡电位Ea分别为:
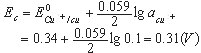 |
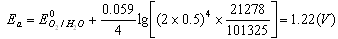 |
|
| 因此,电解硫酸铜溶液时,理论分解电压为:Ud=-E=Ea-Ec (10-2) Ud=1.22-0.31=0.91(v) 如果电解池内阻为0.5Ω,电解电流i为0.1A,实际需要的分解电压高达1.68V,大于理论计算值。这种实际电极电位偏离平衡电位的现象,称为极化现象或极化作用。极化作用的结果产生了过电位。过电位使阳极更正,阴极更负。电解池的过电压η等于阳极过电位ηa和阴极过电位ηc绝对值之和。 有两种极化作用产生的过电位: 1.电化学极化产生过电位 若两电极的电流密度大,Mn+离子在阴极上来不及还原,而使阴极表面积累了过量的电子,因而电极电位向负移动。析出金属时,过电位一般很小,可以忽略;而析出气体(如H2,O2)时,过电位很大,必须考虑。 2.浓差极化引起的过电位 在电极表面,Mn+还原速率很大,使电极表面Mn+浓度很快下降。若溶液中Mn+离子向阴极表面的扩散速率小于电极反应速率,则电极表面的Mn+浓度小于溶液中的Mn+浓度,使阴极平衡电位更负些。搅拌可以消除浓差极化。 由于存在极化作用,分解电压的理论方程式应为:Ud=(Ea+ηa)-(Ec+ηc) (10-3) 将式(10-3)代入式(10-1)中得:U=(Ea+ηa)-(Ec+ηc)+iR (10-4) 式(10-4)称为电解方程式,它表明实际分解电压是理论分解电压、电池的过电位、电解池中的电压降iR之和。 在上述的电解硫酸铜溶液例子中,阳极过电位ηa是0.72V,铂电极的过电位ηc忽略不计,电解时外加电压为:U=(1.22+0.72)-0.31-0.05=1.68(V) 二、 电解分析法的应用 电解分析方法有两种,一是在电解电流保持恒定的情况下进行电解,称为控制电流电解或恒电流电解;二是控制工作电极的电位为一定数值或在一定电位范围内的电解,称为控制电位电解。 (一)控制电流电解法 1.基本装置 控制电流电解法是在电解过程中不断调节外加电压,使通过电解池的电流恒定。其装置如图10-3所示。以串联蓄电池作为直流电源,电源通过可调电阻R与两电极相连。工作电极为网状铂电极,具有较大的表面积。在允许的电流密度下可以使用较大的电解电流,以加快电解速度。另外,网状铂电极也有利于溶液的搅动,可以减小浓差极化。辅助电极是螺旋状或平板状铂阳极,电解时兼作搅拌器。通过电解池的电流一般为0.5~5A。 |
|
| 上一页 下一页 | |