| 第四章 紫外-可见吸收光谱法 |
| 4. 苯及其衍生物 苯有三个吸收带,它们都是由π→π*跃迁引起的。E1带(或称B带)出现在180nm(εmax=60000);E2带出现在255nm(εmax=200)。当苯环上有取代基时,苯的三个特征谱带都将发生显著变化,其中影响较大的是E2带和B带。 当苯环上引入-NH2、-OH、-CHO、 -NO2等基团时,苯的B带显著红移,并且吸收强度增大。此外,由于这些基团上有n电子,故可能产生n→π*吸收带。例如,硝基苯、苯甲醛的n→π*吸收带分别位于330和328nm。 5. 稠环芳烃及杂环化合物 稠环芳烃,如萘、蒽、菲、芘等,均显示苯的三个吸收带。但是与苯相比,这三个吸收带均发生红移,且强度增加。随着苯环数目的增多,吸收波长红移越多,吸收强度也相应增加。 当芳环上的-CH基团被氮原子取代后,则相应的氮杂环化合物(如吡啶、喹啉、吖叮)的吸收光谱,与相应的碳环化合物十分相似。 二、定量分析 紫外-可见分光光度法定量分析的依据是朗伯-比耳定律,即物质在一定波长处的吸光度与它的浓度呈线性关系。因此通过测定溶液对一定波长入射光的吸光度,就可以求出溶液中物质的浓度。 (一)单组分定量分析 1. 标准曲线法 单组分测定常用标准曲线法,这是实际工作中最常用的一种方法。进行定量分析的基本手续是,用已知的标准样品配成一系列不同浓度的溶液,在一定的实验条件和合适的波长下,分别测定其吸光度,然后以吸光度相对于物质浓度作图,得一吸光度与浓度的校正曲线。 理想的校正曲线应为通过原点的直线。利用线性关系,就能求得待测组份中该物质的含量。 2. 标准对比法 在相同条件下测定试样溶液和某一浓度标准溶液的吸光度Ax和As,由标准溶液的浓度Cs可计算出试样中被测物的浓度Cx。这种方法比较简单,但是只有在测定的浓度范围内溶液完全遵守Lambert-Beer定律,并且Cs和Cx很接近时,才能得到较为准确的结果。 (二)多组分定量方法 根据吸光度具有加和性的特点,在同一试样中可以同时测定两个以上的组分。假设试样中含有x,y两种组分,在一定条件下将它们转化产有色化合物,分别绘制其吸收光谱。选择各自的最大吸收波长,测定样品的吸光度。
(三) 示差分光光度法 在一般的分光光度法中,只适于测定微量组分,当待测组分含量高时,吸光度超出了准确测量的读数范围,相对误差比较大。若采用示差分光光度法,有时就可以弥补这一缺点。 一般分光光度测定选用试剂空白或溶液空白作为参比,示差法则选用一已知浓度的溶液作参比。 如果标准溶液浓度为Cs,待测试样浓度为Cx,而且Cx>Cs。根据Beer定律
|
| 上一页 |
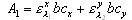 (4-3)
(4-3)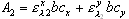 (4-4)
(4-4) 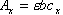
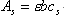
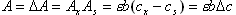 (4-5)
(4-5)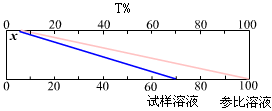
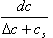 ,Cs是相当大而且非常准确的,所以测定结果的准确度很高。
,Cs是相当大而且非常准确的,所以测定结果的准确度很高。