| 第四章 紫外-可见吸收光谱法 |
| 第三节 紫外-可见分光光度法的应用 一、定性分析 (一)无机物分析 产生无机化合物电子光谱的电子跃迁形式一般分为两大类:电荷跃迁和配位场跃迁。 1. 电荷跃迁 与某些有机化合物相似,许多无机化合物也有电荷迁移跃迁产生的电荷迁移吸收光谱。 若用M和L分别表示络合物的中心离子和配体,当一个电子由配体的轨道跃迁到与中心离子相关的轨道上时,可用下式表示: 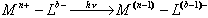 这里中心离子为电子接受体,配体为电子给予体。一般来说,在络合物的电荷迁移跃迁中,金属是电子的受体,配体是电子的给予体。 不少过渡金属离子与含生色团的试剂反应所生成的络合物以及许多水合无机离子,均可产生电荷迁移跃迁。此外,一些具有d10电子结构的过渡元素形成的卤化物及硫化物,如AgBr、PbI2、HgS等,也是由于这类跃迁而产生的颜色。 电荷迁移吸收光谱出现的波长位置,取决于电子给予体和电子接受体相应的电子轨道的能量差。若中心离子的氧化能力越强,或配体的还原能力越强(相反,若中心离子的还原能力越强,或配体的氧化能力越强),则发生电荷迁移跃迁时所需能量越小,吸收光波长红移。 电荷迁移吸收光谱谱带最大的特点是摩尔吸光系数较大,一般εmax>104 。因此,应用这类谱带进行定量分析时,可以提高检测的灵敏度。 2. 配位场跃迁 绝大多数过渡金属离子都兼有未充满的d轨道。按照晶体场理论,当它们在溶液中与水或其它配位体生成络合物时,受配位体配位场的影响,原来能量相同的d轨道会发生能级分裂。分裂后,d轨道之间的能量差称为分裂能。由于d轨道间能量差的存在,络合物就可以吸收适当波长的辐射能,发生d-d跃迁。吸收光的波长取决于分裂能的大小。因此,这种吸收光谱强烈地受配位体性质影响。配位体的配位场越强,d轨道分裂能就越大,吸收峰波长就越短。例如,H2O的配位场强度小于NH3的配位场强度,所以Cu2+的水合离子呈现浅蓝色,吸收峰在749 nm 处,而它的氨合离子呈深蓝色,吸收峰在663 nm处。 一些常见的配位体配位场强弱顺序为: I<Br- Cl- F- OH-<C2O42-=H2O< SCN- < 吡啶=NH3 < 乙二胺 < 联吡啶 < 邻二氮菲 <NO2- < CN- d-d跃迁概率比较小,摩尔吸收系数不大,一般只有0.1-100L.mol-1.cm-1,这类光谱一般位于可见光区。虽然配位场跃迁并不象电荷迁移跃迁在定量分析那么上重要,但它可用于研究络合物的结构,并为现代无机络合物键合理论的建立提供了有用的信息。 (二)有机物分析 在有机化合物的定性和结构分析中,由于紫外-可见光区的吸收光谱比较简单,特征性不强,并且大多数简单官能团在近紫外光区只有微弱吸收或无吸收,因此该方法的应用也有一定的局限性。但它可用于鉴定共轭生色团,以此推断未知物的结构骨架。在配合红外光谱、核磁共振谱等进行结构鉴定分析中,无疑是一个十分有用的辅助方法。 应该指出,分子或离子对紫外光的吸收只是它们含有的生色团和助色团的特征,而不是整个分子或离子的特征。 1. 烃及其取代衍生物 甲烷、乙烷等饱和有机化合物只有σ电子,只产生σ→σ*跃迁,吸收带在远紫外区。当这类化合物的氢原子被电负性大的O、N、S、X等取代后,由于孤对n电子比σ电子易激发,使吸收带向长波移动,故含有-OH、-NH2、-NR2、-OR、-SR、-Cl、-Br等基团时,有红移现象。 直接用烷烃和卤代烃的紫外吸收光谱来分析这些化合物的使用价值并不大。但是,它们是测定紫外和(或)可见吸收光谱时的良好溶剂。 2. 饱和烃及共轭烯烃 此类化合物中除σ键外还含有  键,它们可以产生σ→σ*和π→π*两种跃迁。π→π*跃迁能量小于σ→σ*跃迁。例如,在乙烯分子中,π→π*跃迁最大吸收波长λmax为180
nm。 键,它们可以产生σ→σ*和π→π*两种跃迁。π→π*跃迁能量小于σ→σ*跃迁。例如,在乙烯分子中,π→π*跃迁最大吸收波长λmax为180
nm。在不饱和烃中,当有两个以上的双键共轭时,随着共轭系统的延长,π→π*跃迁的吸收带将明显向长波移动,吸收强度也随之增强。在共轭体系中,π→π*跃迁产生的吸收带又称为K带。 3. 羰基化合物 羰基化合物含有基团,主要可以产生n→σ*、n→π*和π→π*三个吸收带。n→π*吸收带又称为R带,位于禁紫外或紫外光区。醛、酮、羧酸及羧酸衍生物,如酯、酰胺和酰卤等,都含有羰基。由于醛和酮这两类物质与羧酸及其衍生物在结构上的差异,因此它们n→π*吸收带的光区稍有不同。 醛、酮的n→π*吸收带出现在270-300 nm附近,它的强度低(εmax为10-20),并且谱带略宽。 当醛、酮的羰基与双键共轭时,形成了α、β-不饱和醛、酮类化合物,由于羰基与乙烯基共轭,即产生 共轭作用,使n→π*和π→π*吸收带分别移至220-260 nm和310-330 nm。 羧酸及其衍生物的羰基碳原子直接连接含有未共用电子对的助色团,如-OH,-Cl,-OR,-NH2 等。由于这些助色团上的n电子与羰基双键的 电子产生n→π*共轭,导致π*轨道的能级有所提高,但这种共轭作用并不能改变n轨道的能级,因此实现n→π*跃迁所需能量变大,使n→π吸收带蓝移至210nm左右。 |
| 下一页 |