| 第一章 光学分析法导论 |
| 第二节 原子光谱和分子光谱 |
| 原子和分子是产生光谱的基本粒子,由于它们的结构不同,其光谱特性也不同。 一、 原子光谱 原子光谱产生于原子外层电子能级的跃迁,它不但取决于外层电子的运动状态,也取决于电子间的相互作用。 (一)核外电子的运动状态 原子核外电子的运动状态可以用主量子数n、角量子数l、磁量子数m和自旋量子数s来描述。根据能量最低原理、泡利(Pauli)不相容原理和洪特(Hund)规则可以写出基态原子的核外电子排布----电子组态。原子内层电子已经饱和,比较稳定。发生跃迁的电子一般为价电子。所以,在光谱学中更关心的是价电子的组态。 (二)光谱项 由于核外电子之间存在着相互作用,其中包括电子轨道运动之间的相互作用、电子自旋运动之间的相互作用以及轨道运动与自旋运动之间的相互作用等。所以,原子的核外电子排布并不能准确地表征原子的能量状态,原子的能量状态需要用以n、L、S、J四个量子数为参数的光谱项来表征。 n为主量子数,与描述核外电子运动状态的主量子数n意义相同。它是决定原子能量状态的主要参数。 L为总轨道角量子数。各价电子角动量相互作用,按照一定的方式耦合成原子总的量子化轨道角动量。对于具有两个价电子的原子,L只能取下列数值:(l1+l2),(l1+l2-1),(l1+l2-2),…,|l1-l2| (1-3) 即可取(l1+l2)到|l1-l2|,依次递减1的所有数值。例如,对价电子组态为 np1nd1的原子,l1=1,l2=2,于是L可取3、2、1三个数值。L的数值0、1、2、3… 分别用大写字母S、P、D、F…表示。 S为总自旋量子数,它是各价电子自旋角动量耦合后所得总自旋角动量的量子数。若原子有N个价电子,其S可取下列数值: N/2、(N/2-1)、(N/2-2)、…、1/2、0 (1-4) 当价电子为偶数时,S值为零或正整数;价电子为奇数时,S值为半整数。 J为内量子数。它是原子中各价电子总轨道角动量与总自旋角动量耦合得到的原子总角动量的量子数。J可以取以下数值:(L+S),(L+S-1),(L+S-2),,…,|L-S| (1-5) 当L≥S时,J共可取2S+1个数值;当L<S时,J共可取2L+1个数值。 在n、L、S、J四个量子数中,n、L、S确定之后,原子的能级也就基本确定了。所以根据n、L、S三个量子数就可以得出描述原子能级的光谱项:n2S+1L (1-6) 式中2S+1叫作谱项的多重性。如前所述,在L≥S时,2S+1也就是内量子数J可取值的数目,也是同一光谱项中包含的J值不同、能量相近的能量状态数。习惯上将多重性为1、2、3的光谱项分别称作单重态、双重态和三重态。把J值不同的光谱项称为光谱支项,用下式表示:n2S+1LJ (1-7) 在磁场作用下,同一光谱支项会分裂成2J+1个不同的支能级。外磁场消失后,分裂支能级亦消失,此种现象称为能级简并。2J+1为能级的简并度。原子在这些状态上具有相同的概率分布,所以在对某一状态的原子进行统计时,就必须考虑这种简并引起的概率权重-----统计权重。统计权重用符号g表示,在数值上等于该能级的简并度。 如锌原子的基态和激发态的光谱项列于表1-2中。 (三)光谱选律 原子核外的电子在不同状态下所具有的能量,可用能级来表示。离核较远的称为高能级,离核较近的称为低能级。原子在不同能级之间跃迁产生原子光谱,谱线的波长取决于两能级的能量差:  (1-8) (1-8)
原子的各能级都有确定的能量,两能级的能量差必然具有确定的数值。不同能级之间跃迁产生的原子光谱是波长确定、相互分隔的谱线,所以原子光谱称为线光谱。 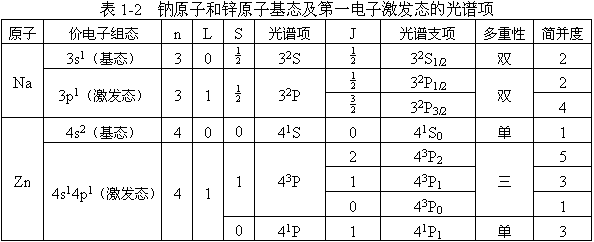 |
| 下一页 |