| 第一章 光学分析法导论 |
| 并不是原子中任何两个能级之间都能发生跃迁。只有符合下述光谱选择定则的跃迁才是允许的:1.ΔL=±1,2.
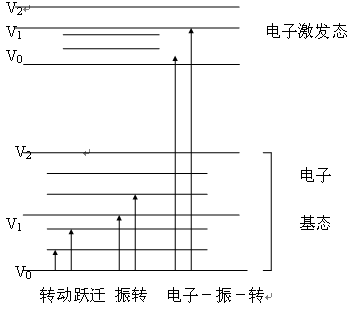
ΔS=0,3.ΔJ=0,但当J=0时,ΔJ=0的跃迁是不允许的。 同时符合以上三个条件的跃迁,其跃迁概率大,谱线较强。不符合光谱选择定则的跃迁叫禁戒跃迁。 (四)原子光谱 物质的原子光谱依其获得方式不同可分为发射光谱、吸收光谱和荧光光谱。 1.原子发射光谱 在一般情况下,原子处于最低能量状态,称为基态(即最低能级)。当原子获得足够的能量后,就会使外层电子从低能级跃迁至高能级。这种状态称为激发态。 原子外层的电子处于激发态是不稳定的,它的寿命小于10-8s。当它从激发态回到基态时,就要释放出多余的能量。若此能量以光的形式出现,即得到发射光谱。 2.原子吸收光谱 基态原子选择性地吸收了来自光源的辐射后,外层电子由基态跃迁至激发态而产生原子吸收光谱。 3.原子荧光光谱 物质的气态原子吸收光辐射后,由基态跃迁到激发态。激发态原子通过辐射跃迁回到基态或较低的能态产生的二次光辐射叫作原子荧光,形成的光谱叫作原子荧光光谱。 二、分子光谱法 (一) 分子能级 分子光谱产生于分子能级跃迁。分子能级比较复杂,因而分子光谱也比较复杂。分子中不但存在成键电子跃迁所确定的电子能级,还存在着振动能级和转动能级,这些能级都是量子化的。电子能级能之间的能量差最大, 一般为1~20eV;振动能级之间的能量差为0.05~1eV;转动能级能量差一般<0.05eV。每个电子能级中都存在着几个可能的振动能级,每个振动能级中又存在若干个可能的转动能级。 双原子分子能级示意图:
|
|||
| 上一页 |