9-5-1配合物电对的氧化还原电位
在上节中,我们已经看到MnIII/MnII电对的氧化还原电位决定于溶液的pH值。在pH=0时电对![]()
![]() 的Eo=+1.51V,但在pH=14时,电对Mn(OH)3/Mn(OH)2的Eo=+0.10V。MnIII的氧化能力显然取决于它的化合的方式。很普遍的方法是加入络合剂就会改变金属特定氧化态的化合方式,例如Eo,Mn(CN)
的Eo=+1.51V,但在pH=14时,电对Mn(OH)3/Mn(OH)2的Eo=+0.10V。MnIII的氧化能力显然取决于它的化合的方式。很普遍的方法是加入络合剂就会改变金属特定氧化态的化合方式,例如Eo,Mn(CN)![]() /Mn(CN)
/Mn(CN)![]() 为-0.22V,而Eo,Mn3+(aq)/Mn2+(aq)=+1.51V,在大为过量的CN—离子存在下,MnIII可成为一个很弱的氧化剂。能量循环可说明Eo的这种变化:
为-0.22V,而Eo,Mn3+(aq)/Mn2+(aq)=+1.51V,在大为过量的CN—离子存在下,MnIII可成为一个很弱的氧化剂。能量循环可说明Eo的这种变化:
(a)Mn(H2O)![]() +e→Mn(H2O)
+e→Mn(H2O)![]()
![]() Go=l
Go=l![]() l.51V
l.51V![]() 96.5kC·mol-1 (ΔrGo=-nFEo)
96.5kC·mol-1 (ΔrGo=-nFEo)
(b)Mn(H2O)![]() +6CN-→Mn(CN)
+6CN-→Mn(CN)![]() +6H2O
+6H2O
![]() Go=-RTlnKII
Go=-RTlnKII
(c)Mn(CN)![]() +6H2O→Mn(H2O)
+6H2O→Mn(H2O)![]() 十6CN-
十6CN-
![]() Go=+RTlnKIII
Go=+RTlnKIII
(d)Mn(CN)![]() +e→Mn(CN)
+e→Mn(CN)![]()
对于(d),
Go=![]() Go(a)+
Go(a)+![]() Go(b)+
Go(b)+![]() Go(c)
Go(c)
=-(1.51![]() 96.5)kJ·mol-1+RT(lnKIII -lnKII)
96.5)kJ·mol-1+RT(lnKIII -lnKII)
式中KII为Mn(CN)![]() 的累积稳定常数,即:
的累积稳定常数,即:
| β[Mn(CN) |
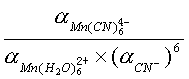 |
即KIII为Mn(CN)![]() 的累积稳定常数,即:
的累积稳定常数,即:
β[Mn(CN) |
|
常数KIII远比KII为大,这是因为Mn(CN)![]() 缺少一个反键电子,很大程度上加强了络合物中的键合。因而反应(d)的
缺少一个反键电子,很大程度上加强了络合物中的键合。因而反应(d)的![]() Go的正值远大于反应(a)的
Go的正值远大于反应(a)的![]() Go,结果使Eo大为降低。
Go,结果使Eo大为降低。
过渡金属电对MnIII/MnII的氧化还原电位受到强场配位体效应是相当普遍的情况。可看出[Fe(H2O)6]3+离子是比[Fe(CN)6]3-强得多的氧化剂。但在少数情况下,强场配位体的加入能增加铁(III)离子的氧化能力。邻二氮杂菲加到Fe3+中就是这种情况,在这一体系中[Fe(phen)3]2+的累积稳定常数比[Fe(phen)3]3+大,因为前者和后者不同,前者是一个低自旋络合物,因而参阅前面的方程式将指出,对于FeIII/FeII体系,其Eo将因邻二氮杂菲的存在而增加,得到的E0,[Fe(phen)3]3+/[Fe(phen)3]2+为+1.14V。