|
上述实例表明,E2反应是立体专一性的,也是立体选择性的,同时也说明了为什么会有这种立体选择性的道理。这首先取决于反式共平面,即两个基团处于相反方向的消除方式。另外也决定反应物的具体结构(构型和构象),这不仅使反应产物具有特定的构型,而且对反应速度也有很大影响。
现在,我们再考查一下活性中间体的构象稳定性对反应产物的影响。例如:
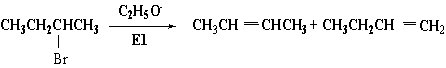 81%
18%
81%
18%
在扎依采夫产物中,反式产物的量大大多于顺式产物。上述反应产物的比例多少可用碳正离子的构象分析来说明。反应活性中间体碳正离子 ,与反应产物有关的构象为(1)、(2)和(3) ,与反应产物有关的构象为(1)、(2)和(3)

(1)

(2)

(3)
构象(1)为斜交叉式,其能量较全交叉式(2)高,所以(2)为主要存在形态,主要得反式烯烃。(3)中有一个较大的基团乙基(-C2H5),所以能量最高,因此霍夫曼烯烃最少。
(二)不饱和体系
不饱和化合物的构象分析主要是指含>C=C<和>C=0双键化合物,此种构象异构现象是沿SP3-SP2碳一碳单键自由旋转而产生的。最简单的例子就是丙烯和乙醛。它们只有两种极端构象:
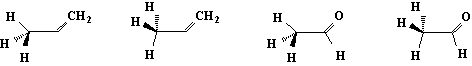
重叠式
平分式
重叠式
平分式
因为在构象式中双键是关键的结构单位,所以凡包括一个双键和一个单键的重叠的构象式称为重叠式;而双键大约均分由SP3杂化中心的两个键所组成的角的构象式,叫做平分(或等分)式,除丙烯和乙醛外,凡是SP3杂化中心碳原子上没有取代基的体系,如乙酸、乙酰氯、乙酸乙酯和丙酮等均只有两种极端构象式,而且都是重叠式较平分式稳定,其原因尚不清楚。
如果不饱和体系的SP3中心含有一个非氢的取代基时,如1一丁烯和丙醛,,则存在四种极端构象,两种重叠式及两种平分式:
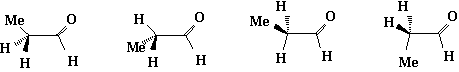
重叠式
平分式
在1-丁烯分子中,氢原子与双键重叠的构象比另一种重叠构象(甲基与双键重迭)稳定;而在丙醛分子中则是甲基与羰基的重叠式比氢原子与羰基的重叠式稳定。这可能是由于甲基和氧原子间的吸引力大于1-丁烯的甲基与双键重叠构象中甲基与CH2的吸引力,或者是由于1-丁烯重叠中非键连的甲基与CH2原子团的相互排斥作用比在丙醛分子中的相同构象中甲基和氧原子间相互排斥作用大。虽然在多数情况下,α一取代衍生物的取代基与不饱和官能团重叠的构象为优势构象。但是,随着取代基的电负性或体积的增大,则将使取代基越趋于偏离该不饱和官能团,另一种重叠式则成为稳定构象。例如:
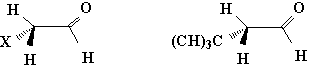
α-卤代醛
X=Cl或Br
3,3
二甲基丁醛
当X=OH或NH2等能与羰基氧原子以氢键相缔合的基团时,则更倾向于以重叠构象的形式存在。例如:
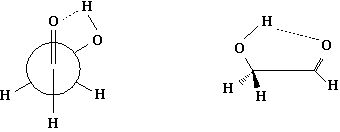
关于酮类的构象分析,经常可以与醛类的情况类比,也是重叠式比较平分式更为有利,取代基与羰基重叠的构象比氢与羰基重迭的构象稳定,这种情况比醛类还要显著。但是,当羰基化合物于格氏试剂、醇铝及金属氢化物等这些试剂作用时,平分式则成为最为有利的优势构象。这被认为是试剂的金属部分能先与羰基氧原子配位,大大地膨胀了羰基氧原子一端的体积。具体反应请见“第五节手性合成”。
二.环状化合物的构象分析
环状化合物的种类很多,包括小环、中环及大环化合物,还有稠环,不饱和环及含杂原子的环状化合物等。因此,环状化合物的构象分析比链状化合更为复杂,而且具有很大的潜力。这里仅就环状化合物构象分析的一般原则,以环已烷及其取代衍生物的某些例子,说明环状化合物的构象对其化学行为的影响。
对环状化合物进行构象分析的一般原则,主要有如下内容:环已烷的椅式构象比船式构象稳定,一种椅式构象可以通过转环作用转变为另一种椅式构象;环已烷的一取代物,取代基处于e键上较a键上的稳定;二取代物中,1,2-二取代物反式较顺式稳定(ee>ae);1,3-二取代物,顺式较反式稳定(ee>ae);1,4-二取代物,反式较顺式稳定(ee>ae)。多元取代物最稳定的构象是e一键取代基最多的构象,环上有不同取代基中,大的取代基为e-型的构象最稳定。十氢化萘中,反式较顺式稳定(ee结合的稳定性大于ea结合);多环化合物中椅式环最多的构象也最稳定。同链状化合物构象分析的一般原则相似,这些原则也同样适用于反应过程中形成的过渡态及活性中间体的构象分析。
影响环已烷衍生物所取优势构象的结构因素很多,其中常见的有:分子内氢键、环型酸酐、环醚,以及稠环、桥环等等。因此在应用一般原则进行构象分析时,也必须注意这些其它因素的参予。
环已烷衍生物的构象对于一个反应活性的影响,和这个反应的反应历程及反应类型有密切关系。关于环已烷衍生物的反应性,对于发生反应的官能团来说,大体上可分为“环内”反应和“环外”反应两类。
最常见的环外反应是环已酸型的羧基的酯化反应、酯基水解反应、和环已醇型的羟基的酰化反应、酰氧基的水解反应。在这一类反应中,对反应速度起决定性作用的是空间效应。所以在一般情况下,α一键上的官能团比e-键上相同的官能团的反应速度要慢得多。其原因是处于a-键的上的官能团比e-键上的要受到更多的立体障碍,例如:4-t-丁基环已基甲酸乙酯在25℃用20%氢氧化钠醇溶液水解时,反式异构体比顺式快20倍。显然,这是由于3a-H和5a-H对1a-羧-酯基的空间阻碍所致。
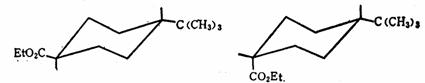
环已烷环上的羟基被氧化成环酮羰基的反应、环上的亲核取代反应、消除反应以及环酮羰基的还原反应、亲核加成反应和环烯双键的亲电加成反应等都是环内反应。大多数环内反应和环外反应不同,反应的基团取α-向位比取e向位容易发生反应,即反应速度较快。这主要有两个原因,一是处于a-向位的基团容易满足许多反应在历程上的立体化学要求。如SN2和E2反应等。二是处于a-向位的官能团发生反应时,有利于解除该功能团与3a和5a-基团或原子之间的相互作用。从而导致所谓“空间加速”现象的产生。例如,4-t-丁基环已醇被铬酸氧化成4-t-丁基环已酮时,其反应速度顺式原料为反式的3.2倍,这与氧化的反应历程密切有关:
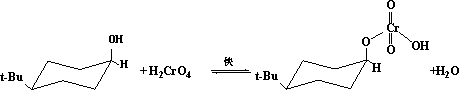
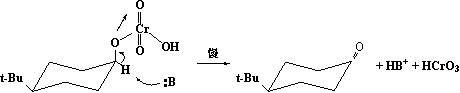
可见,碱(:B)进攻并夺取α-H是定速步骤,顺式醇中α-H处于e-键,空阻小。则易被进攻和离去。反式醇中-OH处于e键,其α-H必须处于a-键,空阻大,不易被:B进攻;而且由于-CrO4H处于a-键上,有利于解除-CrO3H与3aH和5a-H之间的相互作用,导致空间加速现象的产生,所以顺式原料氧化成酮的反应速度比反式原料快。
对于离子型的E2反应来说,必须满足反式共平面的立体化学要求,反应才能发生。在环已烷的衍生物中,反式双a构象才能满足条件;当然,反式双e的构象通过环的翻转也可变成反式双a构象,只是需要一定的能量罢了。但是在一些稠环化合物中,由于环已烷的转环作用完全消失,所以,取代基处于反式双a向的化合物比相应的反式双e向的异构体易发生反应。例如3,4一二溴胆甾烷的两个异构体,在相同的条件下,即用KI催化,于40℃,14天后,反式双a向二溴甾体有91%被消除,而反式双e向的异构体仅1%消除。
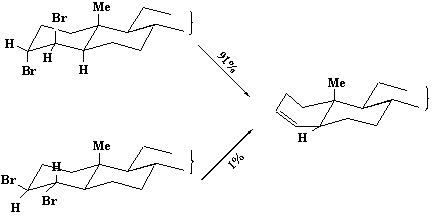
3-胆甾烯
共 2 页
1 2
下一节 |