|
第三节
空间效应
分子中原子之间的相互影响并不能完全归结为电子效应,有些则是与原子(或基)的大小和形状有关的,这种通过空间因素所体现的原子之间的相互影响通常称为空间效应,或叫立体效应(steric
effects)。例如下列两个化合物的酸性经测定为:
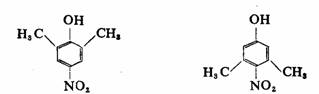
(Ⅰ)
(II)
pKa=7.16
pKa=8.24
(Ⅰ)的酸性强于(II),这从诱导效应和超共轭效应都是无法解释的。两个甲基无论从诱导效应或超共轭效应考虑,在(I)中对酚羟基的供电影响都比在(II)中要大得多,因为甲基的电子效应是减弱酚羟基的酸性的,因此,(I)的酸性应比(II)的酸性弱,但实际却正相反。原因是硝基的体积较大,当硝基的邻位有两个甲基时,由于空间拥挤而使硝基上氮-氧双键的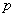 轨道不能与苯环上的 轨道不能与苯环上的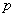 轨道的对称轴完全平行,即硝基氮-氧双键与苯环的共平面性受到破坏,减弱了硝基、苯环与羟基的共轭离域,致使酸性相应降低,这是甲基空间效应作用的结果,这种现象叫做邻位效应。而在(I)中两个甲基离硝基较远,没有明显影响,所以产生上述的结果。 轨道的对称轴完全平行,即硝基氮-氧双键与苯环的共平面性受到破坏,减弱了硝基、苯环与羟基的共轭离域,致使酸性相应降低,这是甲基空间效应作用的结果,这种现象叫做邻位效应。而在(I)中两个甲基离硝基较远,没有明显影响,所以产生上述的结果。
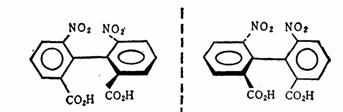
类似的现象,如联苯的邻位有较大的取代基时,常常因空间效应的干扰而使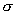 键的自由旋转受阻,呈现了对映异构现象。 键的自由旋转受阻,呈现了对映异构现象。
再例如卤代烷在乙醇解的SN2反应中,随着R体积的大小不同,对乙氧基从背面进攻的难易,由于R的空间阻碍不同而反应速度各异。
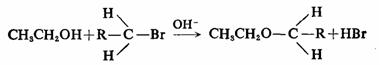
反应物都是伯卤烷,电子效应的差异是不大的,主要是空间阻碍的大小,R愈大则试剂从背面进攻的阻碍也愈大,因而反应速度愈小,空间效应的影响是明显的。
另一类空间效应是由于张力而引起的,空间效应也并不都是阻碍反应进行的,有的是促进反应进行的。例如卤代烷按SN1历程进行的水解反应,首先离解为活性中间体碳正离子,然后与羟基反应,反应分两步进行,总的速度是与碳正离子的稳定性有关的,按伯,仲,叔的顺序反应速度递增。为什么碳正离子的稳定性按伯,仲,叔的顺序递增呢?当然与其电子效应有关,但空间效应也不可忽略,由于反应物卤代烷是四面体结构,中心碳原子为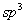 杂化状态,键角接近109.5 杂化状态,键角接近109.5 ,而活性中间体碳正离子为平面结构,中心碳原子为 ,而活性中间体碳正离子为平面结构,中心碳原子为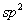 杂化状态,键角为120 杂化状态,键角为120 ,由 ,由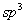 变为 变为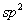 ,原子或基团之间的空间张力变小,容易形成,而且原子或基团的体积愈大时, ,原子或基团之间的空间张力变小,容易形成,而且原子或基团的体积愈大时,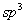 杂化状态下张力也愈大,转变为 杂化状态下张力也愈大,转变为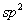 杂化状态张力松弛地也愈明显,形成碳正离子愈容易,碳正离子也愈稳定。 杂化状态张力松弛地也愈明显,形成碳正离子愈容易,碳正离子也愈稳定。
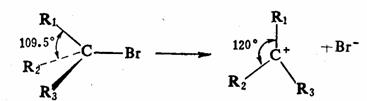
这样的空间张力一般称为B-张力(back
strain,后张力),烷基愈大时对离解速度的影响愈大。
还有一种张力是面对面的空间张力,叫F-张力(face
strain,前张力)。如胺的碱性只从电子效应考虑,预期胺的碱性次序应为:
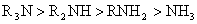
在非水溶剂中,对质子酸确实如此,因为质子体积小,空间因素的影响不大。如果以体积较大的Lewis酸测定,则F-张力的空间效应就非常明显,例如以三烷基硼为Lewis酸与胺作用,R和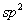 都足够大时,由于R3N与B 都足够大时,由于R3N与B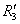 靠近发生相互排挤,上述胺的碱性次序将完全倒转,这即F-张力的影响。 靠近发生相互排挤,上述胺的碱性次序将完全倒转,这即F-张力的影响。

某些环状化合物还存在分子内所固有的I-张力(internal
strain,内张力),主要表现为角张力(angle
strain),如小环烷烃不稳定,容易开环加成,CH2单元燃烧热较高,这是I-张力作用的结果。但某些小环化合物与类似较大环或链状化合物比较,I-张力还有另一种表现形式,如环丙烷衍生物1-甲基-1-氯环丙烷离解为碳正离子比相应的开链化合物叔丁基氯要慢,虽然其中心碳原子都是由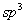 杂化状态转变为 杂化状态转变为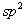 杂化状态,但由于角张力的存在对环丙烷衍生物是极其不利的。 杂化状态,但由于角张力的存在对环丙烷衍生物是极其不利的。

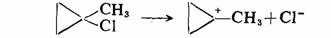
因为几何形状的限制,环中的键角不能扩大,与原卤代衍生物正常键角109.5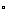 比较,
碳正离子120 比较,
碳正离子120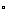 的键角要求,更增大了角张力,所以难于生 的键角要求,更增大了角张力,所以难于生
成,速度减小。又如甲苯磺酸环丙酯,在60℃于醋酸中的溶剂解,以甲苯磺酸环丁酯的速度要小106倍,也说明角张力之影响。
通过以上例子不难看出,与电子效应相似,空间效应对化合物的性质,尤其在反应过程中形成的活性中间体的稳定性影响是较大的,对有机反应的进程起着重要的作用。
空间效应在构象分析上和有机化学反应方向上的影响,在第二章已作了讨论。
本节共 1 页 1
上一节
下一节 |