|
3. 关于碳原于的四面体学说
1874年荷兰青年化学家范特霍夫〔van′tHoff〕和法国青年化学家勒贝尔(Le
BeL)分别提出碳原子的四面体学说,认为碳原子处在一个四面体的中心,四个价键指向四面体的四个顶点。如果四种不同的原于或者基团与四个顶角连接,于是分子(Cabcd)是不对称的,可以有两种物质存在。
碳原子的四面体学说的提出,导致了立体化学的建立。根据碳四面体学说,当时出现的二氯甲烷的结构问题和有光学异构现象的乳酸问题等都得到了满意的解释。
上述的就是经典结构理论的主要内容。经典结构理论的提出,推动有机化学进入了科学阶段,产生了有机化学这门化学学科。此后的发展诸如化学键的电子论、分子轨道理论和电子效应等,都一再证明经典结构理论学说的正确性。
二.有机结构理论的电子学说
1.共价键电子学说
在经典结构理论中,分子中原子之间相互结合的短线的内在涵义是什么,在当时并不清楚。1869年门捷列夫(Mendeleev)发现元素周期律以后,物理学在揭示原子内部的构造方面取得了很大的成就,1897年汤姆逊(J.J.Thomson)发现了电子,1913年玻尔(N.Bohr)提出了著名的原子结构学说。在这些成就的基础上,1916年路易斯(G.N.Lewis)提出了化学键的电子学说。它的主要内容可概括为两点:
(1)化学键是由电子组成的,化学键分为共价键与电价键(离子键)两种,共价键由两个原于共用一对或者数对电子构成,电价键是由正负离子间库仑引力构成的。
(2)进行化学反应时,参与反应的原子可以失去或者获得电子,使原子的外层电子结构接近稀有气体的结构,电子理论认为化学变化只涉及到原子实(Core)外的电子,即价电子的反应。
化学键的电子理论第一次指出了表示原子价的短线是成对的电子,原子间的相互作用是价电子或原子核之间的相互作用。
化学键的电子理论是对经典结构理论的重大发展,并奠定了现代价键理论的基础,直到今天,化合物结构的表示还是以路易斯结构式为基础的。
2.路易斯结构式的书写
经典结构式以短线表示共用电子对,在成键原子的原子核间吸引两核而构成共价键,同时共用电子对充满彼此的价电子层而构成稳定的电子层结构,通常以点表示末共用的电子对。
书写路易斯结构式首先要明确原于及其价电子的标志法。把元素符号代表原子实,即核和内层电子。原子实所带正电荷的数目与价电子数相等,此正电荷称为原子实电荷。价电子画在元素符号的外面,在结构式中,除了在共价键中己共用电子对以短线条表示外,其他末共用的电子对用黑点标示在相应原子的上下。如:
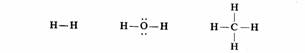
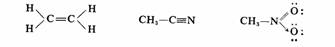
为正确书写路易斯结构式,还需要明确两个概念:第一,原子的价层占有度,为每个原子紧相邻的的总电子数。氢原子的价层占有度不能超过2,第二周期原子不得越过8,第三周期原子可以为l0或12,但不超过18。第二,形式电荷,它等于原子实所带正电荷减去电子主权数。
形式电荷=原于实电荷一电子主权数
所谓电子主权数是指该原子的全部未共用电子数加上这个原子上成键电子的半数。
共
3 页 1
2
3
|