|
第三节 速度控制与平衡控制
有机物结构复杂,反应具有多向性的特点,往往同一反应物、同一试剂在
不同的条件下,反应可按不同途径向不同方向进行,得到不同的产物。在这种情况下,如果为了提高某一产物的得率,就应该从平衡常数和反应的相对速度来寻求答案。有些反应速度较慢而不易建立平衡的有机反应,一般只需从反应速度的角度说明产物的组成,判断竞争反应取向,而不需要考虑反应的可逆性,以及一种产物生成后再转变为另一种产物的问题。在应用这些反应进行有机合成时,就不必按平衡条件,只要按竞争反应中速度最快的反应来设计就可以了。但有机反应中也有不少是比较容易达到平衡的。例如,芳烃的烷基化和磺化反应,以及共轭二烯烃的1,2-和1,4-加成反应等。在研究这些反应主要按哪一种方向进行时,就必须同时考虑化学平衡和反应速度两种因素,必须在了解反应历程的基础上运用化学平衡和反应速度的有关理论对反应加以控制,以期得到我们预想的结果。
例如,反应物A在体系中同时向两种产物B和C方向转变:
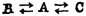 ,如果kB≈kC,则可由两者的平衡常数(KB和KC)来判断哪个反应占优势。若KB和KC相差悬殊,当条件不同时,平衡常数和反应速度均可分别对反应的优势产物起决定性作用。 ,如果kB≈kC,则可由两者的平衡常数(KB和KC)来判断哪个反应占优势。若KB和KC相差悬殊,当条件不同时,平衡常数和反应速度均可分别对反应的优势产物起决定性作用。
现在,我们对反应
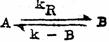 假定:k
B=1000秒-1,k
-B=1秒-1则 假定:k
B=1000秒-1,k
-B=1秒-1则
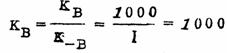
另外假定:κC=100000秒-1,κ-C=10000秒-1,则
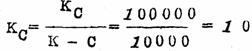
由此可见,尽管
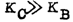 ,但KB要比KC大100倍,因此当反应达到平衡时,产物B肯定是主要产物,此时只有1%的C生成。但是,在反应开始时,生成C的速度要比生成B的快100倍: ,但KB要比KC大100倍,因此当反应达到平衡时,产物B肯定是主要产物,此时只有1%的C生成。但是,在反应开始时,生成C的速度要比生成B的快100倍:
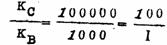
如果控制反应条件,使反应在未到平衡以前就把反应混合物取出分离,那么C肯定是主要产物。
一种反应物向多种产物方向进行时,在反应未达到平衡前,利用反应速度快的特点来控制产物叫做速度控制或动力学控制。利用达到平衡时出现的反应来进行的控制的叫做平衡控制或热力学控制。降低温度或缩短反应时间往往有利于动力学控制的反应,而提高温度或延长反应时间则通常有利于热力学控制的反应。
一种反应物在不同的条件下可以分别得到两种不同的主要产物,从反应进程的角度来讲,是由于这类反应能通过两条具有不同活化能的途径进行反应,结果才得到两种不同的产物、活化能较低的途径为动力学控制产物;在热力学上稳定的产物是热力学控制的产物,也可以说,在一般情况下,逆反应活化能较高的途径为热力学控制产物。
下图是萘磺化反应的反应进程图。磺化反应是可逆的,由于E1<E2,在0~60OC的较低温度下,生成α-萘磺酸的反应速度较快,这时生成α-萘磺酸的逆反应—脱磺酸基反应的速度也很慢,因此反应的主要产物是α-萘磺酸。当温度升高>160OC,对活化能较高的影响较大,加速了β-萘磺酸的生成,α-萘磺酸的脱磺酸基反应的速度也加快,使多数的α-萘磺酸转变为β-萘磺酸,β-萘磺酸脱磺酸基反应活化能(E4)很大,即β-萘磺酸很稳定,它一旦生成,就不容易脱磺酸基而发生逆反应。所以在高温达到平衡时,β-萘磺酸是主要产物。
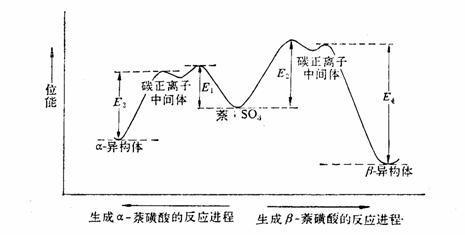
对α-萘磺酸来说,它生成容易,逆反应脱磺酸基也容易。而β-萘磺酸生成难,脱磺酸基也难。因此可利用低温时α-萘磺酸生成快的特点,使α-萘磺酸为主要产物。而在高温或反应时间较长,利用平衡容易建立的特点,使更为稳定的β-萘磺酸为主演产物。总之,在低温时,反应是速度控制因素,高温则由平衡来控制。
共 1 页
上一节
下一节 |