|
第四节 研究反应历程的一般方法
研究有机反应历程,必须有正确的方法,科学的方法、就是从客观真实情况出发,精密地、严格地分析和处理全部的实验结果,从而求得认识客观存在的规律。研究反应历程的方法有很多,各有其优点,可以互相取长补短。常用的一般方法有以下几种。
1.产物的鉴别
研究所有产物的结构和性质是研究反应历程的起点,可对反应历程的推测提供某些线索和旁证:例如,1-溴-2,2-二甲基丙烷在乙醇溶液中与乙醇钠起反应,产物为1-乙氧基-2,2-二甲基丙烷:
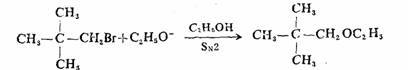
同一溴代烷与含50%水的乙醇起反应,得到的产物为2-甲基-2-丁醇、2-乙氧基-2-甲基丁烷和烯烃:
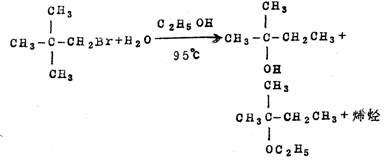
依产物可见,前一个反应是正常的SN2反应,后一个反应是通过碳正离子进行的重排反应。
再例如,甲烷氯化时往往生成少量乙烷,可作为自由基历程的一个旁证。
CH3·+CH3·→CH3CH3
2.中间产物的确定
多步反应中所产生的中间产物大体可分两种,一种是较活泼的中间产物,另一种是十分活泼的活性中间体。前者较易分离得到和测定;后者则寿命短、浓度低,一般不能在常温下分离或检验,直接证明其存在。
中间产物的研究和确定是研究和推测反应历程的重要方法。例如霍夫曼降解反应中,可直接分离和测定两个中间产物—N-溴代酰胺和异氰酸酯:
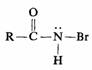
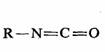
N-溴代酰胺
异氰酸酯
并可间接推测有一个活性中间体酰基乃春(Nitrenes)的存在。因此历程可为:

酰基乃春
3.立体化学方法
测定产物的立体构型往往可以对反应历程提供重要线索。例如,在饱和碳原子上的亲核取代反应中,旋光性化合物有时在反应中发生了构型的转化,有时却发生了外消旋化。这种产物在立体化学上的差异,是由反历程不同而引起的。再如,环己浠与溴的加成反应生成反-1,2二溴环己浣,如果溴分子从双键的一边接近碳原子,同时生成两个碳溴键,应该得到顺-1,2-二溴环已烷,生成反式二溴化物说明加溴反应可能是分步进行的。
4.同位素标记和同位素效应
利用同位素标记反应物(通常是部分标记),反应后测定产物同位素的分布,可使我们知道反应发生在什么部位。这是研究反应历程的重要方法之一。例如,用标记的水(H2O18)水解丁二酸甲酯,得到普通的甲醇和含有O18的丁二酸,令人信服的证明水解反应是通过酰氧键断裂进行的。
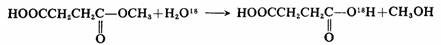
当然,同位素标记还可以得一些关于反应历程的其他信息。例如苯乙胺与亚硝酸作用生成苯乙醇,用14C标记苯乙胺(C※=14C),分析产物物14C的分布,结果为:
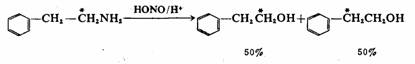
可见,后一种产物是由于苯基从α-碳上迁移到β-碳上而得到的,反应历程明确地说明了为什么在50%的产物中苯基不发生迁移,而另外50%产物中苯基会迁移。
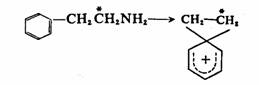
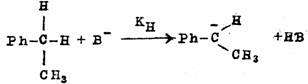
当反应物分子中的氢被重氢置换后,再发生取代或消除等反应时,所表现出的H与D的反应速度不同的现象叫做同位素效应。常以KH/KD之比来表示。同位素效应有第一同位素效应和第二同位素效应两种。所谓第二同位素效应是指尽管连接同位素的键不参与反应,但却表现有同位素效应现象,例如,在下边的三个反应中,KH/KD≌12是第一同位素效应,KH/KD≌1.11是第二同位素效应。一般说,第二同位素效应比第一同位素效应值小。
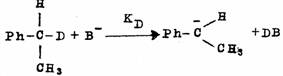
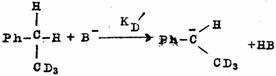
同位素效应可为确定多步反应中的定速步骤提供重要的依据。例如,甲烷的氯化反应,在氯气中通入大量的甲烷,经过短时间光照后,只生成CH3C1,几乎或者完全不生成CH2CI2、CHCl3和CCl4。在同样的反应条件下使CH4和CD4的等量混合物进行光氯化反应,则CH3CI比CD3CI生成的多,说明在下列两个反应中KH/KD>1
CH4
+ Cl·
 CH3· + HCL CH3· + HCL
CD4
+ Cl·
 CD3·+ DCL CD3·+ DCL
说明这一步是卤化反应的定速步骤。因为只有在涉及C—H、C—D键断裂的步骤是决定反应速度的步骤时才会出现这种效应。再例如,在大多数芳香族亲电取代反应中,不存在同位素效应,KH/KD=1.0,这就提供了一个明确的指示,在定速步骤中不涉及C—H键的断裂,氢没有失去。因此,反应至少包括两个步骤和一个中间体:

(KH=KD)
5.动力学方法
在研究反应历程时,动力学方法应用得比较广泛。动力学数据是推测反应历程的主要线索。在一步反应中反应的动力学级数与其分子数是一致的;在多步反应中,每一步的动力学级数与其分子数也是一致的。反应的分子数是推测反应历程的重要依据。但应注意,有时与动力学数据相符合的反应历程往往不止一种,因此,还必须用别的方法进行检验,从几种可能的历程中去掉那些可能性小的。
研究反应历程的手段是多种多样的,近代常用的光学和磁学仪器提供了最敏锐的洞察力,对微观动态化学作了巨大贡献。综合各种手段所得的有关反应历程的结论会更加可靠些。
共 1 页
上一节
下一节 |