|
第三节
芳环上的亲核取代反应
芳环上电子云密度大,富电子的亲核试剂不易接近,芳基正离子(如C6H5+)不稳定、不易生成。因此,芳环上的亲核取代反应对反应物、试剂及反应条件等都有一定限制,大多数的芳香族化合物在芳环上不起亲核取代反应。芳环上的亲核取代反应虽不象饱和碳原子上的亲核取代反应那样广泛,但在理论上和实际合成中也是很重要的。芳环上的亲核取代反应很少是一步反应,而大多数涉及不同的活性中间体。从合成的观点,芳香重氮化合物,其中氮作为离去基团的反应最重要。
一.通过加成—消除历程的取代反应
亲核试剂首先与芳环加成,生成一种叫迈森海默(Meisen
heimer)络合物的活性中间体,然后从中间体中消去一个取代基而完成反应。反应的定速步骤在多数情况下为第一步,是一个双分子反应。
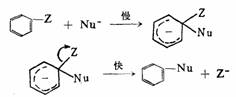
L可为卤素或烷氧基等,L的邻位或对位必须有强吸电子基,如-NO2、-CN、-COR、-CF3等,使中间体的稳定性增加,有助于反应的进行。Nu∶:RO-、CN-、RS-、NH2等
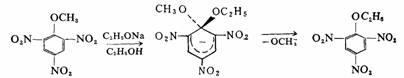
2,4,6-三硝基苯甲醚在乙醚溶液中与乙醇钠反应,迈森海默络合物活性中间体已被分离出来,是个红色的晶体。
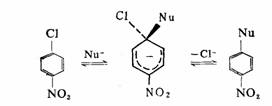
二.通过消除一加成历程(苯炔机理)的取代反应
在正常情况下,芳基卤化物对一般的亲核试剂表现为惰性,但对既是强碱又具有亲核性的试剂则表现为活性。消除一加成机理意味着苯环先消除一个分子,形成高度不稳定的叫做“去氢苯”或苯炔的活性中间体,然后再进行亲核加成而完成的反应。产生苯炔的方法有多种,现仅以卤苯在强碱作用下消除卤化氢为例,说明芳环上亲核取代反应是如何通过消除一加成历程而进行的。

这一机理的特征性为产物的取代类型,引进的亲核试剂不一定都在离去基团所在的位置,还可以在离去基团的邻位。
在苯炔分子中额外键是两个SP2杂化轨道侧面重迭而形成的,重迭程度很小,苯环上的电子云分布在环平面两侧,不与在环平面上的两个SP2重迭,因此,苯炔的稳定性很小,反应性很强,只能在低(8K)下观察其光谱,或用活性试剂截获。
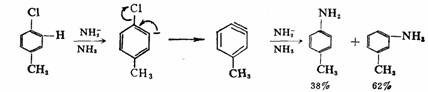
三.通过重氮离子的亲核取代反应
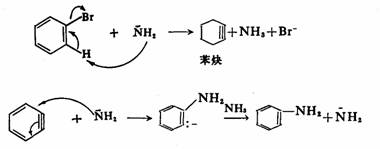
芳香族重氮盐是合成芳香族化合物的一个重要中间体,重氮基(N2+)可被其他原子或原子团取代并放出氮气。重氮基(N2+)离去倾向特别强,故取代反应较易进行。取代机理有三种:第一种是某些反应可能是通过苯基正离子(按SN1机理)进行的,例如:重氮盐的水解生成酚的反应
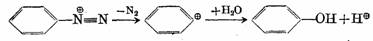
反应速度与重氮盐的浓度成正比,而与亲核试剂的浓度无关,苯环间位上有供电子基时,如-OH、-OCH3、-CH3等可使反应速度加快;有吸电子时,如-COOH、-SO3H、-CI、-NO2等则使反应速度减慢。这些实验事实都与上面的历程相符合,但苯基正离子的结构可能不象上面那样简单。第二种是与亲核试剂加成,取代产物是从加成物上消去氮,即类似加成一消除历程,
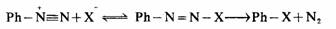
例如,重氮基被氢、氟取代:
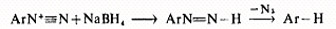

重氮基被氢取代,次磷酸H3PO2也是一个很好的试剂,反应过程也可能生成类似的还原中间体。
第三种机理是认为某些反应是通过自由基完成的。例如在铜盐存在下,-N2+被-CI和-Br取代。这就是桑德迈尔(Sandmeyer)反应。
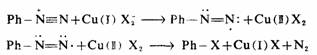
氰基取代重氮基而引入芳环,类似于上述卤素取代反应。
本节共 1 页
上一节
下一节 |