|
2.[4+2]环加成
前面提到狄尔斯-阿尔达尔(简称D-A反应)反应属于[4+2]环加成,它不仅在理论上而且在有机合成上都是具有重要意义的反应。D-A反应也叫二烯合成。
D-A反应可以用通式表示如下:
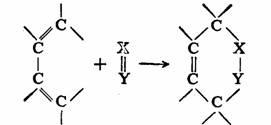
二烯体
亲二烯体
加合物
在狄尔斯-阿尔达尔反应中,两个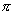 键消失,同时生成两个 键消失,同时生成两个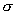 键。由于 键。由于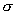 键比 键比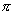 键稳定,故这类反应通常是放热的。例如,在600℃,1,3-丁二烯和乙烯作用的 键稳定,故这类反应通常是放热的。例如,在600℃,1,3-丁二烯和乙烯作用的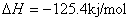 。但放热并不意味着这类反应必然是自发进行的。因为“自发性”受控于反应过程中的活化能,而“放热性”受控于反应物和产物之间的能量差。另外,多数D-A反应在高温是可逆的。 。但放热并不意味着这类反应必然是自发进行的。因为“自发性”受控于反应过程中的活化能,而“放热性”受控于反应物和产物之间的能量差。另外,多数D-A反应在高温是可逆的。
1828年狄尔斯-阿尔达尔发现了二烯合成反应,在以后的几十年中,对该反应作了大量的研究工作,积累了许多实验事实。
(1)反应动力学
D-A反应是二级反应,对每一个反应物都是一级:
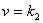 [二烯体][亲二烯体] [二烯体][亲二烯体]
逆反应,即逆D-A过程,通常是一级反应。介质对反应速度没有重大影响。
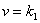 [加合物] [加合物]
(2)区域选择性
具有取代基的反应物,在二烯加成中有两种可能的定向。1-取代的二烯与1-取代的亲二烯体可以生成邻和间位加合物,同样的1-取代亲二烯体与2-取代的二烯能够产生间和对位加合物。实际上,1-取代二烯优先生成邻位加合物,而2-取代衍生物则有利于对位加合物的生成。例如:
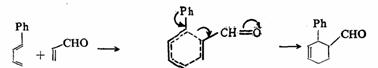
1-取代二烯 过渡态
主要加合物
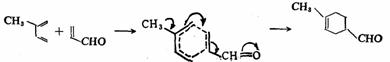
2-取代二烯
过渡态 主要加合物
这种事实可通过协同反应历程来解释。二烯合成的过渡态是一个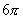 电子体系,类似于苯。在邻位和对位的取代基比其在间位时共轭效应更好(如上式中的弯箭头所示),故在加合物中,1取代二烯所生成的加合物,虽然可以生成邻位和间位两种异构体,但在邻位加合物的过渡态中,由于共轭效应的影响而优生生成(2-取代二烯与此相似)。 电子体系,类似于苯。在邻位和对位的取代基比其在间位时共轭效应更好(如上式中的弯箭头所示),故在加合物中,1取代二烯所生成的加合物,虽然可以生成邻位和间位两种异构体,但在邻位加合物的过渡态中,由于共轭效应的影响而优生生成(2-取代二烯与此相似)。
(3)二烯的活性
由于D-A反应是协同反应,亲二烯体必须在同一时间与二烯的两端起作用。为了使反应能够发生,二烯必须采取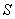 -顺式构象。如果二烯采取 -顺式构象。如果二烯采取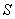 -反式构象,亲二烯体将不能在同一时间去接近二烯的两端。 -反式构象,亲二烯体将不能在同一时间去接近二烯的两端。
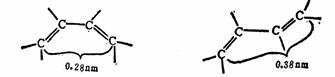
S-顺式
S-反式
虽然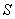 -反式构象比 -反式构象比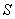 -顺式稳定,但在进行反应时, -顺式稳定,但在进行反应时,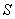 -反式需转变成 -反式需转变成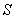 -顺式才能进行反应。如果 -顺式才能进行反应。如果 -顺式不能形成,则反应不能进行。这就说明了为什么下列二烯(I)和(II)在D-A反应中不能作为二烯进行反应,而(III)则可进行反应。 -顺式不能形成,则反应不能进行。这就说明了为什么下列二烯(I)和(II)在D-A反应中不能作为二烯进行反应,而(III)则可进行反应。
(I) (II)
(III)
在链状取代二烯中,取代基的位置、大小和个数等,因对二烯采取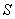 -顺式构象的影响不同,对二烯合成反应的速度将产生不同的影响。例如,四氰基乙烯与反-1,3-戊二烯的反应比与4-甲基-1,3-戊二烯的反应快103倍。因为后者分子内的4位甲基与1位氢原子之间的非键张力的相互作用不利于该分子采取 -顺式构象的影响不同,对二烯合成反应的速度将产生不同的影响。例如,四氰基乙烯与反-1,3-戊二烯的反应比与4-甲基-1,3-戊二烯的反应快103倍。因为后者分子内的4位甲基与1位氢原子之间的非键张力的相互作用不利于该分子采取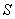 -顺式构象,使 -顺式构象,使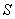 -顺式构象在二烯中的平衡比值较小,故反应速度较小。 -顺式构象在二烯中的平衡比值较小,故反应速度较小。
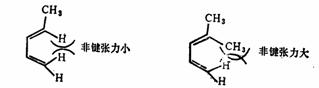
反-1,3-戊二烯
4-甲基-1,3-戊二烯
对于1-取代二烯,顺-1-取代二烯的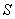 -顺式构象相对于反-1-取代二烯的 -顺式构象相对于反-1-取代二烯的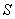 -顺式构象是不利的,这是因为顺-1-取代二烯 -顺式构象是不利的,这是因为顺-1-取代二烯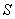 -顺式构象中的取代基与4位氢原子之间存在着非键张力之故。因此,在协同反应中,反式比顺式异构体活泼。例如,反-1-苯基丁二烯与顺丁烯二酸酐的反应比顺式异构体快 -顺式构象中的取代基与4位氢原子之间存在着非键张力之故。因此,在协同反应中,反式比顺式异构体活泼。例如,反-1-苯基丁二烯与顺丁烯二酸酐的反应比顺式异构体快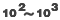 倍。当一个较大的取代基在1-顺位时,反应速度比未取代的二烯(丁二烯)还要小。例如,顺-1-叔丁基-1,3-丁二烯与顺丁烯二酸酐的反应和1,3-丁二烯相比,相对反应速度小于0.05(1,3-丁二烯的相对速度为1)。 倍。当一个较大的取代基在1-顺位时,反应速度比未取代的二烯(丁二烯)还要小。例如,顺-1-叔丁基-1,3-丁二烯与顺丁烯二酸酐的反应和1,3-丁二烯相比,相对反应速度小于0.05(1,3-丁二烯的相对速度为1)。
对于D-A反应,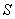 -顺式环状二烯比链状快。因为链状二烯在进行反应时,需要把一般比较稳定的 -顺式环状二烯比链状快。因为链状二烯在进行反应时,需要把一般比较稳定的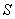 -反式构象通过两个双键之间的单键旋转才能得到所需要的 -反式构象通过两个双键之间的单键旋转才能得到所需要的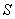 -顺式构象,这种旋转需要一定的能量(尽管所需要的能量较少)。例如,环戊二烯很活泼,通过D-A反应能自身二聚成三环化合物: -顺式构象,这种旋转需要一定的能量(尽管所需要的能量较少)。例如,环戊二烯很活泼,通过D-A反应能自身二聚成三环化合物:
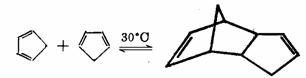
此反应有时被用来由二聚体加热获得环戊二烯。对于链状二烯,这种情况较难发生。
常见的具有代表性二烯化合物有:链状二烯及其衍生物,如丁二烯及其衍生物;环内二烯和某些环外二烯及其衍生物,如环戊二烯和1-乙烯基环已烯等;稠环芳烃,如蒽等。
(4)亲二烯体的活性
亲二烯体的活性依赖于反应的电子要求。在亲二烯体中,有吸电基时,使反应加速进行。例如,四氰基乙烯作为亲二烯体比环戊二烯要快4.6×108倍。亲二烯体中最活泼的是:苯醌、顺丁烯二酸酐、硝基取代的烯烃、α、β-不饱和酯(酮和腈)。但是,当二烯体本身缺乏电子时,则亲二烯体中有供电基反而对加成有利。例如,六氯环戊二烯与苯乙烯的加成,当苯乙烯分子中有供电基时,加速反应的进行。最常见的亲二烯体有烯烃衍生物和炔烃衍生物等。
共4页
1 2
3
4
|